
9、下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)====CO2(g);△H1 C(s)+O2(g)====CO(g);△H2
②S(s)+O2(g)====SO2(g);△H3 S(g)+O2(g)====SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)====2H2O(l);△H6
④CaCO3(s)====CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)====Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
8.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
7、 25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+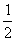 O2(g)=CO(g);△H=-393.5 kJ/mol
O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.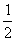 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol
6、已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mo
l
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
5、氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g) + 1/2O2(g) = H2O(l);△H= —285.8 kJ/mol
CO(g) + 1/2O2(g) = CO2(g);△H= —283.0 kJ/mol
C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H= —5518 kJ/mol
CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H= —890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
1、热化学方程式C(s)+H2O(g)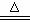 CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
2、已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625kJ·g-1。下列热化学方
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
2、已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625kJ·g-1。下列热化学方
程式中不正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-890kJ/mol
B.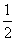 CH4(g)+O2(g)=
CH4(g)+O2(g)=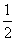 CO2(g)+H2O(l);△H =-445kJ/mol
C.
CO2(g)+H2O(l);△H =-445kJ/mol
C.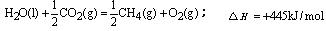 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-55.625kJ/mol
3、在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol-125KJ/mol
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-55.625kJ/mol
3、在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol-125KJ/mol
的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,△H =-23.4kJ/mol,
以上事实表明( ) A.1,3—环己二烯加氢是吸热反应 B.苯加氢生成环己烷是吸热反应 C.1,3—环己二烯比苯稳定 D.苯比1,3—环己二烯稳定 4、X、Y二元素的原子,当它们分别获得两个电子形成稀有气体元素原子层结构时,X
放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成
稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y和Z、W分别形成的
化合物中,离子化合物可能性最大的是( ) A.Z2X B.Z2Y C.W2X D.W2Y
2. 据盖斯定律计算化学反应的焓变
进行反应的焓变计算应注意的问题
(1) 由于△H与反应物的物质的量有关,因此热化学方程式中化学式前面的化学计量 数必须与△H相对应。如化学计量数成倍减少或增加,则△H也要成倍的减少或成倍的增加。当反应向逆向进行时,其反应热与正反应的反应热数值相等,正负号相反。
在使用盖斯定律时,伴随着两个或多个方程式的加减处理时,△H的计算一定要带上
|

[例1](2010江苏卷,17)
下表列出了3种燃煤烟气脱硫方法的原理。
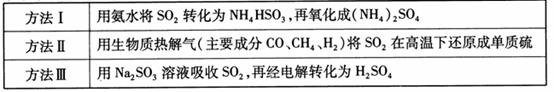
(1)
方法Ⅰ中氨水吸收燃煤烟气中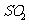 的化学反应为:
的化学反应为:
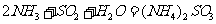
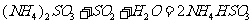
能提高燃煤烟气中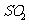 去除率的措施有 ▲ (填字母)。
去除率的措施有 ▲ (填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D.
通入空气使 转化为
转化为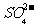
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的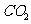 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。
(2) 方法Ⅱ重要发生了下列反应:
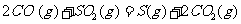
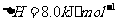

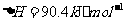

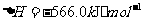
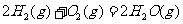

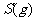 与
与 反应生成
反应生成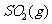 的热化学方程式为
。
的热化学方程式为
。
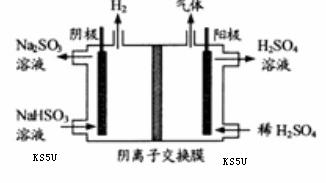
(3)
方法Ⅲ中用惰性电极电解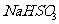 溶液的装置
溶液的装置
如右图所示。阳极区放出气体的成分为 。
(填化学式)
[答案]
(1)AC
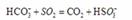
(2)S(g)+O2(g)= S O2(g) H=-574.0kJmol-1
(3) O2 SO2
[解析]本题考察的知识比较散,涉及到环境保护,一道题考察了几个知识点。覆盖面比较多。但盖斯定律、热化学方程式、离子方程式、点击方程式都是重点内容(1)提高SO2的转化率,可以增大氨水的浓度、与氨水充分接触;不需要通入CO2的原因是因为HCO3+SO2=CO2+HSO3而产生CO2 (2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。(3)阴极的电极产生的气体为O2和SO2.
[例2](2010广东理综卷,9)
在298K、100kPa时,已知:2 ⊿
⊿
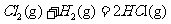 ⊿
⊿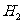
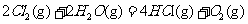 ⊿
⊿
则⊿ 与⊿
与⊿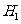 和⊿
和⊿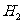 间的关系正确的是
间的关系正确的是
A
.⊿ =⊿
=⊿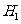 +2⊿
+2⊿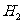 B ⊿
B ⊿ =⊿
=⊿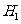 +⊿
+⊿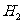
C.
⊿ =⊿
=⊿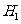 -2⊿
-2⊿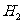 D. ⊿
D. ⊿ =⊿
=⊿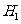 - ⊿
- ⊿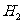
解析:第三个方程式可由第二个方程式乘以2与第一个方程式相加,有盖斯定律可知
答案:A
[例3](2010天津卷,10)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:___________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g)
+ 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
解析:(1)煤生成水煤气的反应为C+H2O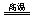 CO+H2。
CO+H2。
(2)既然生成两种酸式盐,应是NaHCO3和NaHS,故方程式为:
Na2CO3+H2S==NaHCO3+NaHS。
(3)观察目标方程式,应是①×2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ· mol -1。
正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低;故选c、e。
(4)此时的浓度商Q=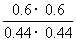 =1.86<400,反应未达到平衡状态,向正反应方向移动,故
=1.86<400,反应未达到平衡状态,向正反应方向移动,故 正>
正>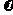 逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=
逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=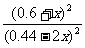 ,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
由表可知,甲醇的起始浓度度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,
10min变化的浓度为1.6 mol·L-1,故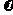 (CH3OH)=0.16 mol·L-1·min-1。
(CH3OH)=0.16 mol·L-1·min-1。
答案:(1) C+H2O CO+H2。
CO+H2。
(2) Na2CO3+H2S==NaHCO3+NaHS
(3) -246.4kJ· mol -1 c、e
(4) ①> ②0.04 mol·L-1 0.16 mol·L-1·min-1
命题立意:本题是化学反应原理的综合性试题,考查了化学方程式的书写、盖斯定律的应用、化学平衡移动原理,和利用浓度商和平衡常数的关系判断平衡移动的方向、平衡常数和速率的计算等。
反应热单元测试
1. 盖斯定律:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓(热量)
变是一样的。
2.书写热化学方程式时明确以下问题:
(1)反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,未特别注明的指101kPa和25℃时的数据。
(2)物质的聚集状态不同,反应吸收和放出的热量不同,因此要注明反应物和生成物的聚集状态。
(3)热化学方程式中的热量数据,是与各化学计量数为物质的量时相对应的,不是几个分子反应的热效应。因此式中化学计量数可以是整数,也可以是分数。一般出现分数时是以某一反应物或生成物为“1mol”时其它物质才出现的。
(4)无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数有关。
|

[例1](2010浙江卷,12)下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
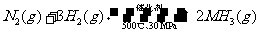 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
C. 氯化镁溶液与氨水反应: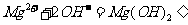
D. 氧化铝溶于NaOH溶液:
试题解析:
本题考查热化学方程式与离子方程式的书写。A、标准燃烧热的定义,1mol可燃物完全燃烧生成稳定氧化物时方出的热量(标准指298K,1atm)。水液态稳定,方程式系数就是物质的量,故A错。B、根据热化学方程式的含义,与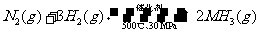 对应的热量是1mol氮气完全反应时的热量,但次反应为可逆反应故,投入0.5mol的氮气,最终参加反应的氮气一定小于0.5mol。所以△H的值大于38.6。B错。D、氢氧化铝沉淀没有沉淀符号。
对应的热量是1mol氮气完全反应时的热量,但次反应为可逆反应故,投入0.5mol的氮气,最终参加反应的氮气一定小于0.5mol。所以△H的值大于38.6。B错。D、氢氧化铝沉淀没有沉淀符号。
本题答案:C
教与学提示:
化学用语的教学是化学学科技术规范,强调准确性,强调正确理解与应用。特别重视热化学方程式的系数与反应热的对应关系。重视离子方程式的拆与不拆的问题。热化学方程式的书写问题由:聚集状态、系数、系数与反应热数值对应、反应热单位、可逆反应的反应热等内容构成。离子方程式的书写问题由:强弱电解质、最简整数比、定组成规律、离子方程式正误判断、守恒、定量离子方程式等内容组成。
[例2](2010安徽卷,25)
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H-Y、H-Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+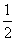 O2(g)=XO2(g)
O2(g)=XO2(g)  H=-283.0 kJ·mol-2
H=-283.0 kJ·mol-2
Y(g)+ O2(g)=YO2(g)  H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
答案:(1)3 VIA HClO4
(2)2 H-Z H-Y
(3)[Ar]3d104s1 2Cu2S+3O2=2Cu2O+2SO2
(4)2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ/mol
解析:由表中可知,X为C Y为 S Z为 Cl W为Cu
|

第3课时 反应焓变的计算
1. 热化学方程式与普通化学方程式的区别有三点不同
(1)热化学方程式必须标有热量变化。
(2)热化学方程式中必须标明反应物和生成物的状态,因为反应热除跟物质的量有关外,还与反应物和生成物的聚集状态有关。
(3)热化学方程式中各物质的系数只表示各物质对应的物质的量,因此,有时可用分数表示,但要注意反应热也发生相应变化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com