
20.(13分)W、X、Y、Z是原子序数依次增大的同一周期元素,原子序数均小于18,W、X是金属元素,Y、Z是非金属元素。
(1)已知:W、X各自的氧化物对应的水化物可以反应生成盐和水,写出X的氧化物与过量氢氧化钠溶液反应的离子方程式 。
(2)W与Y可形成化合物W2Y,该化合物水溶液呈碱性,用离子方程式解释其原因:
。
(3)Y的某氧化物通入Z单质的水溶液中,发生反应生成两种强酸的化学方程式为:
。
(4)写出Z-离子的核外电子排布式: 。
(5)W、X、Y、Z四种元素简单离子的半径由小到大的顺序是
< < < (写离子符号)。
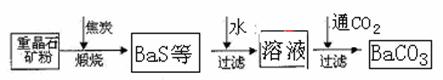 21.(8分)工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
21.(8分)工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2 kJ•mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s) △H=-1473.2 kJ•mol-1
Ba(s)+S(s)=BaS(g) △H=-460 kJ•mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
19.(7分)通常状况下,X,Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的主族元素;Y和Z为元素R组成的同素异形体,反应Y+2I-+2H+=I2+Z+H2O常作为Y的鉴定反应。
(1)Y与I2的氧化性关系是 > (填化学式)。
(2)写出工业上用电解法制备X气体时,阳极上的电极反应式 。
(3)用足量的CO还原4.64g含R的铁的化合物FemRn,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则m:n= .
17.金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”。工业上以金红石(TiO2)为原料制取Ti的反应为:
|
aTiO2+bCl2+Cc=====aTiCl4+cCO ………………反应(1)
|
TiCl4+2Mg===========Ti+2MgCl2 ………………反应(2)
关于反应(1)、(2)的分析正确的是 ( )
A.TiCl4在反应(1)中是氧化产物,在反应(2)中是氧化剂
B.C、Mg在反应中均为还原剂,被氧化
C.在(1)反应方程式中,a一定等于2
D.每生成9.6gTi,反应(1)、(2)中共转移电子均为0.6mol
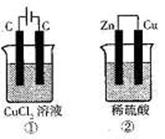 18.如右图所示的两个实验装置中,溶液的体积均为200mL,
18.如右图所示的两个实验装置中,溶液的体积均为200mL,
开始时电解质溶液的浓度均为0.1mol·L-1,工作一段时
间后,测得导线中均通过0.02mol电子,若不考虑溶液
体积的变化,则下列叙述中不正确的是 ( )
A.电极上产生气体的体积:①=②(相同条件)
B.①和②中溶液的pH都减小
C.电极上析出物质的质量:①>②
D.电极上发生氧化反应:①中阳极,②中负极
第Ⅱ卷(非选择题,共56分)
15.稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
A.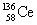 、
、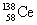 、
、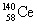 、
、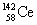 它们互称为同素异形体
它们互称为同素异形体
B.工业上可以采用电解氯化铈水溶液来获得铈单质
C.铈溶于氢碘酸的主要化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑
D.工业上金属铈一般保存在敞口容器中
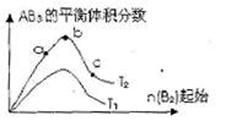 16.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
16.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是 ( )
2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是 ( )
A.达到平衡时A2的转化率大小为:b>a
B.a、b、c三点的平衡常数相同
C.若T2>T1,则正反应一定是吸热反应
D.b点时,平衡体系中A、B原子数之
比一定是1:1
14.向1.00 L 0.3mol·L-1NaOH溶液中缓慢通入CO2气体至溶液增重8.8g。有关该溶液说法正确的是 ( )
A.溶质为Na2CO3
B.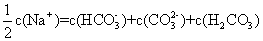
C.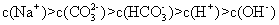
D.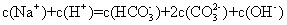
12.某混合溶液中所含离子的浓度如下表,则Mn+离子及a值可能为 ( )
|
所含离子 |
NO-3 |
SO2-4 |
H+ |
Na+ |
Mn+ |
|
浓度(mol·L-1) |
3 |
1 |
2 |
1 |
a |
A.Mg2+、1 B.Ba2+、0.5 C.Al3+、1.5 D.Fe2+、2
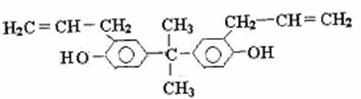 13.据《华盛顿邮报》报道,美国食品与药物管理局2009年10月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如下图),并不会对婴儿或成人的健康构成威胁。关于双酚A的下列说法正确的是 ( )
13.据《华盛顿邮报》报道,美国食品与药物管理局2009年10月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如下图),并不会对婴儿或成人的健康构成威胁。关于双酚A的下列说法正确的是 ( )
A.该化合物属于芳香烃
B.该化合物与三氯化铁溶液反应显紫色
C.双酚A不能使溴水褪色,但能使酸性的高锰酸钾溶液褪色
D.1mol双酚A最多可与4mol Br2发生加成反应
11.下列离子方程式正确的是 ( )
A.向次氯酸钙溶液中通入SO2:Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰使SO2-4沉淀完全
NH+4+Al3++2Ba2++2SO2-4+4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓
C.硫化铜固体中加入硫酸锌稀溶液[已知
Ksp(CuS)<Ksp(ZnS)]:CuS+Zn2+==ZnS+Cu2+
D.向硝酸银溶液中滴加稀氨水至过量:
AgNO3+NH3·H2O==AgOH+NH4NO3
10.常温下pH为2的盐酸,下列叙述正确的是 ( )
A.将10mL该溶液稀释至100mL后,pH小于3
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.该溶液中由水电离出的c(H+)(水)×c(OH-)(水)==1×10-14
D.该溶液中盐酸最离的c(H+)与水最离出的c(H+)之比为1010:1
9.四氯化硅还原法是当前制备较高纯度硅的一种方法,有关反应的化学方程式为:
|
SiCl4(g)+2H2(g) ====Si (s)+4HCl(g)。下列说法合理的是 ( )
A.光导纤维的主要成分是硅单质
B.减小压强有利于加快化学反应速率
C.高温下,氢气的还原性强于硅
D.混入少量空气对上述反应无影响
8.甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
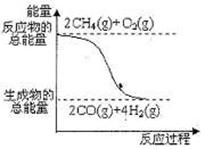 ①2CH4(g)+O2(g)=2CO(g)+4H2(g); △H=-71kJ·mol-1
①2CH4(g)+O2(g)=2CO(g)+4H2(g); △H=-71kJ·mol-1
②CO(g)+2H2(g)=CH3OH(l) ; △H=-90.5kJ·mol-1
下列描述错误的是( )
A.CO(g)+2H2(g)==CH3OH(g)
△H>-90.5kJ·mol-1
B.在甲醇燃料电池中,甲醇所在电极为正极
C.CH4(g)+1/2o2(g)===CH3(OH)(l)
△H=-126kJ·mol-1
D.反应①中的能量变化如右图所示
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com