
35.[化学-有机化学基础]
近年来,宁夏在煤的深加工方面投入了大量资金,宁东集团成为龙头企业,有利的带动了当地经济的发展,以煤为原料制备一些化工产品的前景被看好。将煤干馏后在电炉内与CaO反应可以制得乙炔等一系列产品。已知:
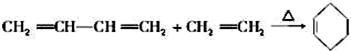
物质A在体内脱氢酶的作用下会氧化为有害物质GHB。下图是关于物质A的一种制备方法及由A引发的一系列化学反应。
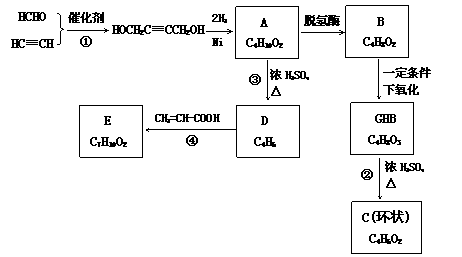
请回答下列问题:
(1)写出反应类型:反应①___________,反应③___________。
(2)写出化合物B的结构简式______________________。
(3)写出反应②的化学方程式________________________________________。
(4)写出反应④的化学方程式________________________________________。
 (5)反应④中除生成E外,还可能存在一种副产物(含 结构),它的结构简式为___________。
(5)反应④中除生成E外,还可能存在一种副产物(含 结构),它的结构简式为___________。
(6)与化合物E互为同分异构体的物质不可能为___________(填写字母)。
a.醇 b.醛 c.羧酸 d.酚
34.[化学-物质结构与性质]  (15分)
(15分)
 已知元素A、B、X、N、Z原子序数依次递增。Z的原子序数为29,其余的均为短周期元素。B元素的最外层电子数是其电子层数的3倍,A与N相邻,N元素原子的M电子层的P亚层中有3个未成对电子,X元素的M层电子数是其K层电子数的2倍。回答下列问题:
已知元素A、B、X、N、Z原子序数依次递增。Z的原子序数为29,其余的均为短周期元素。B元素的最外层电子数是其电子层数的3倍,A与N相邻,N元素原子的M电子层的P亚层中有3个未成对电子,X元素的M层电子数是其K层电子数的2倍。回答下列问题:
 (1)X与A可以形成一种高温结构陶瓷材料。X的氯化物分子呈正四面体结构,X的氧化物的晶体类型是______________;
(1)X与A可以形成一种高温结构陶瓷材料。X的氯化物分子呈正四面体结构,X的氧化物的晶体类型是______________;
 (2)A的具有相同化合价且可以相互转变的氧化物是_______;
(2)A的具有相同化合价且可以相互转变的氧化物是_______;
(3)Z2+ 的核外电子排布式是 。
 (4)
(4) A、N这两个元素的氢化物分子中,①氢化物的沸点从高到低排列次序是(填化学式)_____________,其原因是_______________
A、N这两个元素的氢化物分子中,①氢化物的沸点从高到低排列次序是(填化学式)_____________,其原因是_______________
 ②A、B、X、N的氢化物的化学式和立体结构分别是_________;
②A、B、X、N的氢化物的化学式和立体结构分别是_________;
 (5)X和A所形成的结构陶瓷材料的一种合成方法如下:X的氯化物与A的氢化物加热反应,生成化合物X(AH2)4和HCl气体; X(AH2)4在高温下分解生成A的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
(5)X和A所形成的结构陶瓷材料的一种合成方法如下:X的氯化物与A的氢化物加热反应,生成化合物X(AH2)4和HCl气体; X(AH2)4在高温下分解生成A的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
 __________________________________
__________________________________
28.(8分)请分析下表,回答有关实验的问题。
|
组
别 |
材 料 |
实
验 条
件 |
观察内容 |
|
|
A |
A1 |
|
染液 |
线粒体 |
|
A2 |
0.9%NaCl溶液、8%盐酸.吡罗红甲基绿染色剂 |
DNA和RNA在细胞中的分布 |
||
|
B |
浸泡过的花生种子 |
清水、苏丹Ⅳ染液、 50%酒精溶液 |
细胞中着 色的小颗粒 |
|
|
D |
紫色洋葱鳞片叶外表皮 |
解离液、0.3g/mL蔗糖溶液、清水 |
|
(1)请在上表的 填补适当的内容。
(2)A1组实验中,在显微镜下观察到的线粒体呈 色。A2组实验中,盐酸的作用是 ,加速染色剂进入细胞,同时使 ,有利于DNA与染色剂结合。
(3)D组实验中,如果在显微镜下观察不到任何变化,原因可能是 。
选考题(每科选做1题)
考生从给出的2道物理题、2道化学题中任选1题解答,2道生物题中任选1题解答并用2B铅笔在答题卡上把所选题目的对应题号涂黑。注意所做题目必须与所涂题目一致,在答题卡选答区域指定位置答题。
27.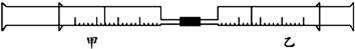 (15分)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
(15分)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10mL FeSO4溶液 |
10mL NH3 |
生成白色沉淀,后变色 |
|
2 |
20mL H2S |
10mL SO2 |
|
|
3 |
30mL NO2(主要) |
10mL H2O(l) |
剩有无色气体,活塞自动向内压缩 |
|
4 |
9mL Cl2 |
24mL NH3 |
|
试回答下列问题:
(1)实验1中,沉淀最终变为_______色,写出沉淀变色的化学方程式_______________。
(2)实验2甲针筒内的现象是:有_______生成,活塞___________移动(填“向外”“向内”或“不”)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入________溶液中。
(3)实验3中,甲中的30mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是__________,写出NO2与H2O反应的化学方程式_____________________。
(4)实验4中,已知:3Cl2+2NH3 N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为________,最后针筒内剩余气体的体积约为________mL。
N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为________,最后针筒内剩余气体的体积约为________mL。
26.(14分)物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,A易被磁性物质吸引,B常温下为液态化合物。
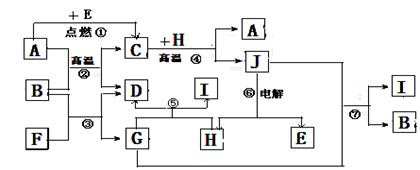
试回答下列有关问题:
(1)A在元素周期表的位置 周期 族
(2)单质E和单质F在点燃或加热的条件下生成的淡黄色固体是 (填化学式);其电子式 。
(3)写出反应②的化学方程式: ,
(4)写出引发反应④的实验操作 ,
写出该反应一种重要的工业用途 ,
(5)写出反应⑤的离子方程式: 。
(6)写出用A与H作电极材料插入G溶液形成闭合电路后的正极反应是 。
25.(14分)下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
⑥ |
⑦ |
⑧ |
|
⑨ |
⑩ |
|
(1)②、⑤、⑦的原子半径由小到大的顺序为_________________________。
(2)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是______________________。
(3)①、④、⑤、⑩中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见微粒情况如下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
①用化学符号表示下列4种微粒:
A: B: C: D:
②写出A、B、E三种微粒反应的离子方程式:
13.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是 ( )
A.密闭容器中CuO和C高温反应的气体产物: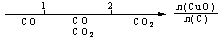 B.Fe在Cl2中的燃烧产物:
B.Fe在Cl2中的燃烧产物: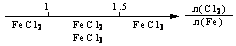
C.AlCl3溶液中滴加NaOH后铝的存在形式: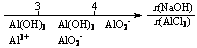
D.氨水与SO2反应后溶液中的铵盐: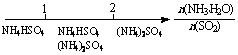
 第Ⅱ卷
第Ⅱ卷
12.信息:在治疗甲型流感的疫苗尚未研制面世之前,科学家一直表示,达菲类流感特效药可治疗这种新型流感病毒,它可由我国特有中药材八角的提取物--莽草酸(shikimicacid)为原料合成的。已知莽草酸和达菲的结构式如下: ( )

根据题意,下列判断正确的是 ( )
A.它们互为同系物
B.莽草酸能使溴的四氯化碳溶液褪色,达菲不能
C.达菲的分子式C16H28N2O4•H3PO4
D.莽草酸与FeCl3溶液显紫色
11.将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),该b L气体中NH3的体积分数是 ( )
A.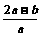 B.
B.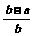 C.
C. 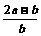 D.
D. 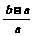
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com