
4.(4分)(1)除去粗盐中的SO42+ ………………………………………………2分
(2)Mg2+ + 2OH- == Mg(OH)2↓………………………………………2分
3.(4分)(1)化合物 ………………………………………………………………1分
(2)Fe2O3 …………………………………………………………………1分
(3)萃取 …………………………………………………………………1分
分液漏斗 ………………………………………………………………1分
2.(3分) ② ………………………………………………………………………1分
① ………………………………………………………………………1分
③ …………………………………………………………………………1分
1.(3分)SnO2 ………………………………………………………………………1分
C …………………………………………………………………………1分
1 …………………………………………………………………………1分
15.(10分)有机物A是重要的化工原料。主要用于医药工业中,是合成药物的中间体,并可作为塑料、染料等产品的中间体。下图是合成有机物A的逆合成分析。
|
|||||||||||||||||||||
 |
|||||||||||||||||||||
 |
|||||||||||||||||||||
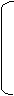 |
|||||||||||||||||||||
 |
|||||||||||||||||||||
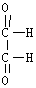 |
|||||||||||||||||||||
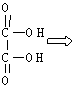 |
|||||||||||||||||||||
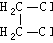 |
|||||||||||||||||||||
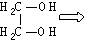 |
|||||||||||||||||||||
 |
 |
||||||||||||||||||||
(1)经燃烧分析实验测定,有机物B中各元素的质量分数是碳52.2%,氢13.0%,氧34.8%。通过质谱法测定,B的相对分子质量为46。红外光谱表明B中有羟基O-H键,B的结构简式为 ,
(2)合成有机物A的基础原料的结构简式为 。
(3)写出下列反应的化学方程式。
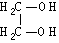
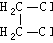
 ①
①
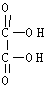
|

|
(4)有机合成后,必须测定其结构才能确定它是否就是目标产物。有机物A的核磁共振氢谱有 (填数字)种类型氢原子的吸收峰。
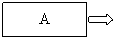
14.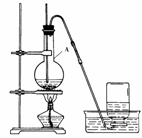 (5分)实验室制取乙烯的装置如右图所示。请回答:
(5分)实验室制取乙烯的装置如右图所示。请回答:
(1)A中加入的两种试剂是 。
发生反应的反应类型是 。
(2)A中加入几片碎瓷片的作用是
。
(3)反应温度应控制在 (填序号)。
① 140℃ ② 170℃
(4)收集乙烯的方法是 。
13.(5分)(1)葡萄糖是分布最广的单糖,分子中有五个羟基,是一种多羟基的 。检验葡萄糖是否具有还原性,可使用新制Cu(OH)2或
。
(2)油脂具有酯的化学性质,在酸、碱等的作用下可发生 反应。
(3)蛋白质是由氨基酸通过肽键(结构简式为 )构成的高分子化合物。聚乙烯属于合成材料,结构简式为 。
12.(10分)在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)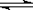 CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
|
t/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)能说明该反应达到化学平衡状态的是 (填字母)。
a.υ正(CO2)=υ正(H2) b.υ逆(CO)=υ逆(H2O)
c.υ逆(H2)=υ逆(H2O) d.υ正(H2)=υ逆(H2)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得 c(CO) = 0.0080 mol/L ,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
《有机化学基础》
11.(5分)常温下,两种溶液① 0.1 mol/L NH3·H2O ② 0.1 mol/L NH4Cl中:
(1)溶液①的pH 7(填“>”、“<”或“=”),其原因是
(用电离方程式表示)。
(2)溶液②呈 性(填“酸”、“碱”或“中”)。水解反应是吸热反应,升温可以
(填“促进”或“抑制”)NH4Cl 的水解。
(3)下列关于两种溶液中c(NH4+) 的叙述正确的是 (填字母)。
a.两种溶液中c(NH4+) 都等于0.1 mol/L
b.两种溶液中c(NH4+) 都小于0.1 mol/L
c.NH4Cl溶液中c(NH4+) 小于NH3·H2O溶液中c(NH4+)
10.(5分)(1)金属腐蚀一般可分为化学腐蚀和 腐蚀。
(2)炒过菜的铁锅未及时洗净容易发生腐蚀。
①若铁锅内残液呈弱酸性,则腐蚀属于 (填“吸氧”或“析氢”,下同)腐蚀;若残液中主要含有NaCl,腐蚀应属于 腐蚀。
②吸氧腐蚀中,负极的电极反应式为 。
铁锈中铁的化合价为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com