
读右图,完成9-10题。
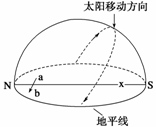
9.若图中a、b两地属同一时区,同一时刻,但日期不同,则图中经线x的度数为 ( )
A.20°W B.0°
C.160°E D.180°
10.一架飞机由a沿某一纬线向b飞,在a地为12月31日10时整,到达b地上空共用了2分钟,则b地时刻为 ( )
A.12月31日10时02分 B.12月30日10时02分
C.12月30日10时整 D.第二年1月1日10时02分
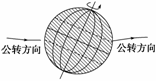 读右图(阴影部分为夜半球),回答7-8题。
读右图(阴影部分为夜半球),回答7-8题。
7.若此刻西半球为夜半球,太阳直射点的经度是 ( )
A.东经70° B.东经90°
C.西经70° D.西经110°
8.此日在 ( )
A.3月21日前后 B.6月22日前后
 C.9月23日前后
D.12月22日前后
C.9月23日前后
D.12月22日前后
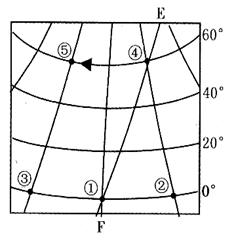 图中EF线是地球公转到近日点附近的晨昏线,箭头为地球自转方向,①点是东半球与西半球的分界线,②点位于西半球,①点与②、③两点的最短距离是3330km。据此回答4-6题:
图中EF线是地球公转到近日点附近的晨昏线,箭头为地球自转方向,①点是东半球与西半球的分界线,②点位于西半球,①点与②、③两点的最短距离是3330km。据此回答4-6题:
4.图中⑤点的地理坐标是( )
A.10ºE,60ºS
B.150ºW,60ºN
C.170ºE,60ºS
D.30 ºE,60ºN
5.图示时刻北京时间是( )
A. 3:20 B.8:40
C. 15:20 D. 20:40
6.图中④点的昼长约为( )
A.8小时 B.10小时
C.14小时 D.16小时
3.甲(23°26′N、160°E),乙(13°26′S、160°W)两点,按“劣弧定向法”判断,甲点在乙点的:( )
A.东北 B.西北 C.西南 D.东南
2.下列经纬网四图中,P点位置符合下列条件的是:①在东半球 ②在北半球 ③在中纬度( )
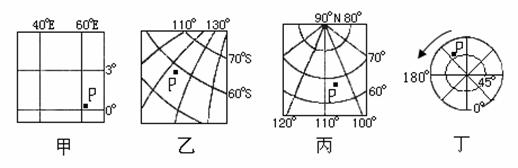
A.甲 B.乙 C.丙 D.丁
1.有关经度和纬度的正确说法是:①在地球仪上,经线指示南北方向,纬线指示东西方向
②每条经线的长度都相等,每条纬线的长度也相等 ③在地球仪上,每条纬线都是圆(南北极点除外) ④从某地出发,沿着同一条经线朝同一方向走,最后能回到出发地点。( )
A. ①② B. ②③ C. ③④ D. ①③
22.(A)(每个1分,共10分)(1)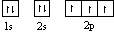 ;(2)N>P>S;(3)分子,直线,CO2 (N2O、CS2,写1个即可),
;(2)N>P>S;(3)分子,直线,CO2 (N2O、CS2,写1个即可),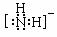 sp3;(4)配位键(写共价键也可) YBa2Cu3O7;
sp3;(4)配位键(写共价键也可) YBa2Cu3O7;
15.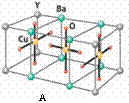 (2008年1月扬州二模)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
(2008年1月扬州二模)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为______________________________。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为___________。
(3)HN3属于___________晶体,N3-的空间构型是_____,与N3-互为等电子体的分子的化学式为___________(写1种)。NH2-的电子式为___________,其中心原子的杂化类型是___________。
(4)CuCl2-中的键型为___________,超导氧化物A的化学式为___________。
(5)治癌药物B的结构简式为_________________。
14.请完成下列各题:
(1)氢负离子H-基态的电子排布式是_____。
(2)下列变化:H-(g)=H(g)+e-吸收的能量为73 kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311 kJ·mol-1l,则氢负电子H-的第一电离能为_____________________。
(3)氢原子能与许多元素化合形成化合物。右图中“·”代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“·”代表未成键价电子,短线代表一个化学键。如H2O表示为: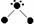
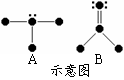 ① 写出A、B两种分子的立体结构及其中心原子的杂化方式________,________。
① 写出A、B两种分子的立体结构及其中心原子的杂化方式________,________。
② C、D与A具有相似的分子结构,且A、C、D三种分子的中心原子属于同族非金属,试推测由A、C、D构成的三种纯净物中沸点最高的是________(填A、C、D),原因是_______________________________________________。
(1)1s2;(2)73 kJ·mol-1;(3)①根据判断分子结构的理论可以判断出A为三角锥形,中以原子采用sp3杂化,B为平面三角形,中心原子采用sp2杂化。 ②A的沸点最高,A中存在氢键,C、D中不存在氢键。
13.(2008南京一模)(1)前三周期元素中第一电离能最小的是___________ (填元素符号),其基态原子的电子排布式为______________________。第二周期非金属元素形成的氢化物中化学键极性最大的是__________(填分子式),该物质在CCl4中的溶解度比在水中的溶解度_______ (填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
|
代号 |
物质 |
结构简式 |
水中溶解度/g(25℃) |
熔点/℃ |
沸点/℃ |
|
A |
邻-硝基苯酚 |
 |
0.2 |
45 |
100 |
|
B |
对-硝基苯酚 |
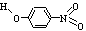 |
1.7 |
114 |
295 |
(3)晶格能的大小:MgO___________NaCl,键能的大小:HBr___________HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是___________
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CH4 C.SiF4>NaF>NaCl>NaBr
(1)Na 1s22s22p63s1 HF 小 (各1分);(2)B 2分 ;(3)> > 各2分 ;(4)B (2分) w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com