
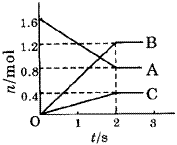
图1 A、B、C三种物质的物质的量随时间变化的关系图
例1.某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
解析:这类题目是讨论同一时间段内各物质的变化量的比例关系,且要注意物质的量减少的为反应物,物质的量增多的为生成物。又因物质的量都不变时,反应物、生成物共存,故方程式要用“ ”表示。
答案:2A
”表示。
答案:2A 3B+C;0.08mol/(L·s);0.12mol/(L·s)。
2.速率-时间图象
例2.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1-t2速率变化的主要原因是_________;t2-t3速率变化的主要原因是_________。
3B+C;0.08mol/(L·s);0.12mol/(L·s)。
2.速率-时间图象
例2.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1-t2速率变化的主要原因是_________;t2-t3速率变化的主要原因是_________。
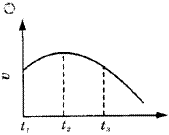
图2 氢气发生速率变化曲线
解析:这类题目是讨论速率受外界条件影响而变化的图象。因速率随时间延长先升高后降低,故速率要受反应过程中物质的浓度、温度(或压强)两种因素变化的影响。
答案:反应是放热反应,温度升高使化学反应速率提高;盐酸物质的量浓度变小使化学反应速率降低。
例3.某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2+O2 2SO3(正反应放热)的正、逆反应速率的影响如图3所示。
2SO3(正反应放热)的正、逆反应速率的影响如图3所示。
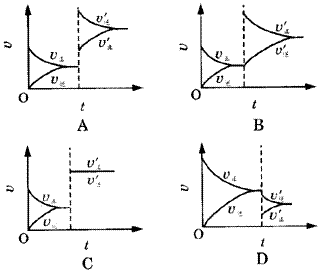
图3 正、逆反应速率的变化曲线
①加催化剂对速率影响的图象是( )。 ②升温对速率影响的图象是( )。 ③增大反应容器体积对速率影响的图象是( )。 ④增大O2的浓度对速率影响的图象是( )。 解析:这类图象是讨论外界条件对化学平衡的影响。解决这类题目的关键是分析改变条件的瞬间,正、逆反应速率的变化及变化幅度。 答案:①C ②A ③D ④B。 3.速率-压强(或温度)图象
例4.符合图象4的反应为( )。
A.N2O3(g) NO2(g)+NO(g)
NO2(g)+NO(g)
B.3NO2(g)+H2O(l)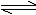 2HNO3(l)+NO(g)
2HNO3(l)+NO(g)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
D.CO2(g)+C(s) 2CO(g)
2CO(g)
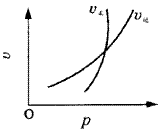
图4 曲线图
解析:此类图象中曲线的意义是外界条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度。 答案 B
4.转化率(或质量分数等)-压强、温度图象
例5.有一化学平衡mA(g)+nB(g) pC(g)+qD(g),如图5所示是A的转化率同压强、温度的关系,分析图5可以得出的正确结论是( )。
pC(g)+qD(g),如图5所示是A的转化率同压强、温度的关系,分析图5可以得出的正确结论是( )。
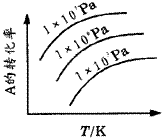
图5 曲线图
A.正反应吸热,m+n>p+q B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q D.正反应放热,m+n<p+q 解析:解决这类图象题目,采用“定一论二”,即把自变量(温度、压强)之一定为恒
量,讨论另外两个变量的关系。 答案
A
例6.mA(s)+nB(g) qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图6所示,有关叙述正确的是( )。
qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图6所示,有关叙述正确的是( )。
A.n<q B.n>q C.X点,v正>v逆;Y点,v正<v逆 D.X点比Y点反应速率快
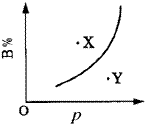
图6 曲线图
解析:这类题目中曲线是表示“平衡”时,质量分数与压强(或温度)变化关系曲线。X、Y点则未达平衡状态,反应要向“趋向于平衡状态方向”进行,以此判断某点v正、v逆的大小关系。比较X、Y两点的速率快慢则依据压强的高低(或温度的高低)。 答案 A、C。
5、络合平衡:络离子在水中电离出中心体和配位体的速率和中心体的离子与配位体结合成络离子的速率相等时,即各物百分含量保持不变的状态,称络合平衡.
4、水解平衡:盐中的弱酸根或弱碱阳离子和水发生水解反应速率和中和反应速率在一定条件下相等,即各物百分含量保持不变的状态,称为水解平衡。
①NaHCO3水溶液呈现碱性.Al2(SO4)3溶液呈现酸性的原因。
NaHCO3为强碱弱酸酸式盐,电离出的HCO3-和水发生水解,由于中和反应的存在,在一定条件下达到平衡,当达到平衡时,[OH-]>[H+],所以溶液呈现碱性.
Al2(SO4)3是强酸弱碱盐,在水中电离出来的Al3+和水发生水解反应,由于中和反应的存在,在一定条件下达到平衡,当达到平衡时,[H+]>[OH-],所以溶液呈现酸性.
②用水解平衡解释泡沫灭火器的反应原理
泡沫灭火剂由两种物质组成:玻璃瓶中装有明矾[KAl(SO4)2·(12H2O)]、钢筒与玻璃瓶之间装有NaHCO3溶液,待混合时,各自单水解产生的H+和OH-结合成难电离的水,打破了各自的单水解平衡,分别向水解方向移动,水解较能彻底地进行,产生气体CO2及沉淀Al(OH)3.反应如下:
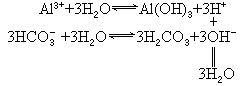
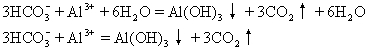
3、电离平衡:弱电解质在一定温度下,在水中电离成离子的速率和离子结合成分子的速率相等,即溶液中的溶质分子和电离出来的离子浓度保持不变的状态,称电离平衡。
用电离平衡解释中和等物质的量的HCl和HAc所消耗的NaOH的物质的量相同。
HCl为一元强酸,全部电离,NaOH为一元强碱,全部电离,所以1mol NaOH(提供1mol OH-)中和1molHCl(提供1molH+);HAc是一元弱酸,在溶液中存在电离平衡;HAc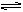 H++Ac-,当在HAc溶液中加入NaOH时,产生的OH-和HAc电离出的H+结合成难电离的水,从而打破HAc的电离平衡,所以会使NaOH完全中和HAc,也就是1molNaOH完全中和1molHAc(未考虑水解)。
H++Ac-,当在HAc溶液中加入NaOH时,产生的OH-和HAc电离出的H+结合成难电离的水,从而打破HAc的电离平衡,所以会使NaOH完全中和HAc,也就是1molNaOH完全中和1molHAc(未考虑水解)。
3、溶解平衡:难溶性物质在水中在一定条件下溶解速率和结晶速率相等,即各物质百分含量保持不变的状态.
①用溶解平衡解释CaCO3为什么难溶于水而溶解在比H2CO3强的可溶性酸中.
CaCO3是难溶于水的盐,不溶是相对的,溶解是绝对的,CaCO3放入水中存在一个溶解平衡,CaCO3是强电解质,溶解的部分全部电离成Ca2+、CO32-,具体用下式表示:
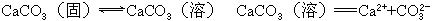
把上述二式合并便是溶解平衡的化学方程式.
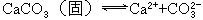
当强酸放入CaCO3中,强酸中的水使CaCO3形成溶解平衡,强酸电离出的H+和CO32-结合生成CO2从体系中逸出,使平衡向溶解的方向移动,使CaCO3溶解在盐酸中,具体过程用下式表示:
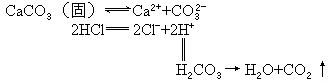
②用溶解平衡原理解释为什么氢氧化铝既溶解在强酸又溶解在强碱溶液中。
Al(OH)3是难溶于水的碱,溶解是绝对的,不溶是相对的,在氢氧化铝悬浊液中存在一个溶解平衡.而溶解的氢氧化铝存在两个平衡:酸式电离平衡和碱式电离平衡.在氢氧化铝悬浊液中加入强酸时,提供大量的H+,则和碱式电离出的OH-结合成难电离的水,打破碱式电离平衡,进一步打破溶解平衡,使Al(OH)3溶解在强酸中;悬浊液中加入强碱,电离大量的OH-,和Al(OH)3酸式电离出来的H+结合成难电离的水,破坏酸式电离平衡,又破坏了溶解平衡,使Al(OH)3溶解在强碱溶液中,可用下式表示:
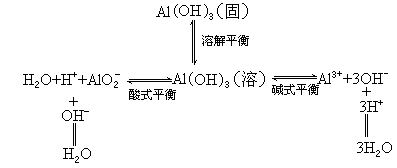
所以Al(OH)3既可溶解在强酸中又可溶解在强碱溶液中.
2、用化学平衡解释SiO2+Na2CO3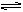 Na2SiO3+CO2↑发生反应的原理.
Na2SiO3+CO2↑发生反应的原理.
按照酸酐和含氧酸盐反应规律应当是CO2+Na2SiO3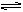 Na2CO3+SiO2,但为什么SiO2能和Na2CO3发生反应.原因是:SiO2+Na2CO3
Na2CO3+SiO2,但为什么SiO2能和Na2CO3发生反应.原因是:SiO2+Na2CO3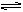 Na2SiO3+CO2↑可看作是可逆反应,当在高温时,CO2从体系中逸走,则平衡向右移动,可发生上述反应.
Na2SiO3+CO2↑可看作是可逆反应,当在高温时,CO2从体系中逸走,则平衡向右移动,可发生上述反应.
化学平衡的具体应用:化合反应和分解反应在一定条件下反应速率相等,各物质百分
含量保持不变的状态,为化学平衡.
1、用化学平衡解释浓H2SO4具有强氧化性、稀H2SO4具有弱氧化性。
SO3+H2O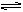 SO3·H2O
SO3·H2O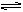 2H++SO42-
2H++SO42-
平衡体系中的SO3具有强氧化性、H+具有弱氧化性、SO42-无氧化性,浓H2SO4中,水少,则平衡向左移动,SO3浓度增大,所以氧化性增强;稀H2SO4中水多,平衡向右移动,SO3浓度减少而H+浓度增大,呈现弱氧化性.
3.定温、定压条件下,反应前后气体分子数任意型的可逆反应
例3.(2003年高考江苏卷第26题)
I.恒温、恒压下,在一个可变容积的容器中发生如下反应:
A(气)+B(气) C(气)
C(气)
(1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的量为__________mol。
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成C的物质的量为________mol;
(3)若开始时放入x mol A、2 mol B和1 mol C,到达平衡后,A和C的物质的量分别是y mol和3a mol,则x=___mol,y=___mol。平衡时,B的物质的量___(选填一个编号)。
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2 mol
作出此判断的理由是__________________________________________。
(4)若在(3)的平衡混合物中再加入3 molC,待再次到达平衡后,C的物质的量分数是____________。
II.若维持温度不变,在一个与(I)反应前起始体积相同、且容积固定的容器中发生上述反应
(5)开始时放入1 mol A和1 mol B到达平衡后生成b mol C。将b与(1)小题中的a进行比较_________(选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是__________________________________________。
解析:(1)利用关于化学平衡计算的三步骤解题法可以算出答案 (1-a)mol;
(2)适用上面等效平衡规律c,由于开始加入的物质的量之比相等都为3,两平衡等效且平衡时各物质的量均为原来的3倍,所以生成C的物质的量为3a;
(3)平衡时C的物质的量为3a与第(2)题平衡时C的物质的量相等,属于绝对量相等的等效平衡,相当于开始加入了3molX和3molY,可计算出X=2mol,Y=(3-3a)mol。若平衡时C的物质的量为3a大于C的起始物质的量1mol,则反应正向进行,平衡时B的物质的量nB<2mol;同理可知:3a=1,nB=2mol;3a<1,nB>2mol选丁;
(4)由于生成物只有C一种,因此在恒温、恒压下无论加入多少C,平衡时各物质的物质的量分数都不变,所以再次到达平衡后,C的物质的量分数是a/(2-a);
解题规律:此条件下,只要按化学计量数换算到同一半边后,各物质的量之比与原平衡相等,则两平衡等效。
三类等效平衡的比较:
|
等效类型 |
I |
II |
III |
|
|
条件 |
恒温、恒容 |
恒温、恒容 |
恒温、恒压 |
|
|
起始投料 |
换算为方程式同一边物质,其“量”相同 |
换算为方程式同一边物质,其“量”符合同一比例 |
换算为方程式同一边物质,其“量”符合同一比例 |
|
|
对反应的要求 |
任何可逆反应 |
反应前、后气体体积相等 |
任何可逆反应 |
|
|
平衡特点 |
质量分数W% |
相同 |
相同 |
相同 |
|
浓度c |
相同 |
成比例 |
相同(气体) |
|
|
物质的量n |
相同 |
成比例 |
成比例 |
2.定温、定容条件下,反应前后气体分子数相等的可逆反应
例2.恒温恒容下,可逆反应2HI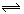 H2+I2(气)达平衡。下列四种投料量均能达到同一平衡,请填写:
H2+I2(气)达平衡。下列四种投料量均能达到同一平衡,请填写:
|
|
起始状态物质的量n/mol |
平衡时HI的物质的量n/mol |
||
|
H2 |
I2 |
HI |
||
|
1 |
2 |
0 |
a |
|
|
① |
2 |
4 |
0 |
|
|
② |
|
|
1 |
0.5a |
|
③ |
m |
g(g≥2m) |
|
|
解析:
∵题干n(H2)起始:n(I2)起始:n(HI)平衡=1:2:a<==>2:4:2a
∴n(HI)平衡=2a
根据反应:2HI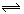 H2+I2(气),起始状态1mol
HI<==>0.5molH2+0.5molI2
根据题干n(H2)起始:n(I2)起始:n(HI)平衡=1:2:a
则 n(H2)起始:n(I2)起始:n(HI)平衡=0.5:1:0.5a
则H2和I2原有物质的量应为0和1-0.5=0.5mol
设起始HI为x mol
∵x mol HI<==>0.5x molH2+0.5x molI2
∴n(H2)起始=(m+0.5x) mol
n(I2)起始=(g+0.5x) mol
又∵n(H2)起始:n(I2)起始=(m+0.5x):
(g+0.5x)=1:2
∴x=2(g-2m)
设n(HI)平衡为ymol,
则n(I2)起始: n(HI)平衡=2:a= (g+0.5x):y
∴y=(g-m)a
答案:
H2+I2(气),起始状态1mol
HI<==>0.5molH2+0.5molI2
根据题干n(H2)起始:n(I2)起始:n(HI)平衡=1:2:a
则 n(H2)起始:n(I2)起始:n(HI)平衡=0.5:1:0.5a
则H2和I2原有物质的量应为0和1-0.5=0.5mol
设起始HI为x mol
∵x mol HI<==>0.5x molH2+0.5x molI2
∴n(H2)起始=(m+0.5x) mol
n(I2)起始=(g+0.5x) mol
又∵n(H2)起始:n(I2)起始=(m+0.5x):
(g+0.5x)=1:2
∴x=2(g-2m)
设n(HI)平衡为ymol,
则n(I2)起始: n(HI)平衡=2:a= (g+0.5x):y
∴y=(g-m)a
答案:
|
|
起始状态物质的量n/mol |
平衡时HI的物质的量n/mol |
||
|
H2 |
I2 |
HI |
||
|
1 |
2 |
0 |
a |
|
|
① |
2 |
4 |
0 |
2a |
|
② |
0 |
0.5 |
1 |
0.5a |
|
③ |
m |
g(g≥2m) |
2(g-2m) |
(g-m)a |
解题规律:此条件下,只要换算到同一半边时,反应物(或生成物)的物质的量 的比例与原平衡相等,则两平衡等效。
在一定条件(定温、定压或定温、定容)下,对于同一可逆应,只要起始时加人物质的物质的量不同,而达到平衡时,同种物质的物质的量分数(或体积分数)相同,这样的平衡称为等效平衡。根据反应条件(定温、定压或定温、定容)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成三类:
1.定温、定容条件下,反应前后气体分子数不相等的可逆反应
例1.在一固定体积的密闭容器中,加入2 mol A和1 mol B发生反应2A(g)+B(g)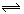 3C(g)+D(g),达到平衡,c的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,c的浓度仍为w mol/L的是
A. 4 mol A +2 mol
B B. 1 mol A+0.5 mol B+1.5
mol C+0.5 mol D
C. 3 mol C+1 mol D +1
mol B D. 3 mol C+1 mol D
解析:根据题意:
2A(g)+B(g)==3C(g)+D(g)
(反应1)<==>
2A(g)+B(g)==3C(g)+ D(g)(反应2)
2mol 1mol 0 0 0 0 3mol 1mol
2A(g)+B(g)==3C(g)+D(g)
(反应3)<==> 2A(g)+B(g)==
3C(g) + D(g)(反应4)
1mol 0.5mol 0 0 0 0 1.5mol 0.5mol
在恒温恒容下,反应(1)的浓度和压强均是反应(3)的2倍,不满足条件相同,显然不等效,若要变成等效,有两条途径:
①对反应(3)增加1molA和0.5 molB,使投料量与反应(1)相同。
②因反应(3)与反应(4)等效,增加1.5molC和0.5 molD相当于增加1molA和0.5 molB,使投料量与反应(1)相同。则反应(3)变成
2A(g)+B(g)==3C(g)+D(g)
(反应1)<==> 2A(g) +
B(g) == 3C(g) + D(g)(反应3)
2mol 1mol 0 0 1mol 0.5mol 1.5mol 0.5mol
所以,以3 mol C+1 mol D或以1mol A+0.5 mol
B+1.5mol C+0.5 mol D作为起始物质均可形成与反应(1)等效的平衡。答案:BD
解题规律:此种条件下,只要改变起始加入物质的物质的量,若通过可逆反应的化学计量数之比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效(此种情况下又称等同平衡,此法又称极限法)。
3C(g)+D(g),达到平衡,c的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,c的浓度仍为w mol/L的是
A. 4 mol A +2 mol
B B. 1 mol A+0.5 mol B+1.5
mol C+0.5 mol D
C. 3 mol C+1 mol D +1
mol B D. 3 mol C+1 mol D
解析:根据题意:
2A(g)+B(g)==3C(g)+D(g)
(反应1)<==>
2A(g)+B(g)==3C(g)+ D(g)(反应2)
2mol 1mol 0 0 0 0 3mol 1mol
2A(g)+B(g)==3C(g)+D(g)
(反应3)<==> 2A(g)+B(g)==
3C(g) + D(g)(反应4)
1mol 0.5mol 0 0 0 0 1.5mol 0.5mol
在恒温恒容下,反应(1)的浓度和压强均是反应(3)的2倍,不满足条件相同,显然不等效,若要变成等效,有两条途径:
①对反应(3)增加1molA和0.5 molB,使投料量与反应(1)相同。
②因反应(3)与反应(4)等效,增加1.5molC和0.5 molD相当于增加1molA和0.5 molB,使投料量与反应(1)相同。则反应(3)变成
2A(g)+B(g)==3C(g)+D(g)
(反应1)<==> 2A(g) +
B(g) == 3C(g) + D(g)(反应3)
2mol 1mol 0 0 1mol 0.5mol 1.5mol 0.5mol
所以,以3 mol C+1 mol D或以1mol A+0.5 mol
B+1.5mol C+0.5 mol D作为起始物质均可形成与反应(1)等效的平衡。答案:BD
解题规律:此种条件下,只要改变起始加入物质的物质的量,若通过可逆反应的化学计量数之比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效(此种情况下又称等同平衡,此法又称极限法)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com