
2、盐类水解的实质_________________________________________________________。
注意以下几点:
①能发生水解反应的盐,必须是含有弱根离子(弱碱阳离子或弱酸根离子)的可溶性盐。如__________________________
②盐类水解过程就是水的电离平衡移动过程,也就是说,盐类的水解能促进水的电离。使水的电离度增大。即在常温下,可水解盐溶液中由水电离出的c(OH_)___10-7mol/L.(>、<、=)
③盐类水解反应生成酸和碱,所以盐类水解反应可看着是中和反应的逆反应。
 [练习]
[练习]
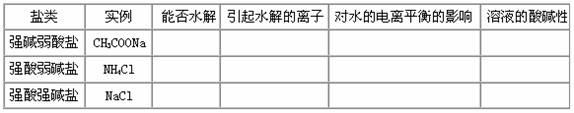
1、盐类水解的类型和规律
(1)强碱弱酸盐的水解:CH3COONa的水解
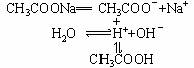
CH3COONa+H2O CH3COOH+NaOH或 CH3COO-+H2O
CH3COOH+NaOH或 CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
CH3COONa溶于水时,CH3COONa电离出的CH3COO-和__电离出的H+结合生成难电离的__,消耗了溶液中的__,使水的电离平衡向___移动,产生更多的__,建立新平衡时,c(OH-)__c(H+),从而使溶液显__性。
[小结] ①这种在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
②只有弱酸的阴离子或弱碱的阳离子才能与H+或OH-结合生成弱电解质。
③盐类水解使水的电离平衡发生了移动,并使溶液显酸性或碱性。
④盐类水解反应是酸碱中和反应的逆反应。
[讨论]分析 Na2CO3的水解过程,写出有关反应的离子方程式。
第一步:CO32-+H2O
 HCO3-+OH-(主要)
HCO3-+OH-(主要)
第二步:HCO3-+H2O  H2CO3+OH-(次要)
H2CO3+OH-(次要)
与Na2CO3, CH3COONa类似的还有Na2S,NaCN,Na3PO4,Na2SiO3,Na2CO3.
(2)强酸弱碱盐的水解
应用盐类水解的原理,分析NH4Cl溶液显酸性的原因,并写出有关的离子方程式。
NH4Cl溶于水时电离出的NH4+与水电离出的OH-结合成弱电解质NH3·H2O,消耗了溶液中的OH-,使水的电离平衡向右移动,产生更多的H+,建立新平衡时,c(H+)>c(OH-),从而使溶液显酸性。
离子方程式:NH4++H2O NH3·H2O+H+
NH3·H2O+H+
与NH4Cl类似的还有CuSO4,FeCl3
写出下列盐水解的离子方程式:
FeCl3
NH4Cl
(3)以 NaCl为例,说明强酸强碱盐能否水解。
由于 NaCl电离出的 Na+和Cl- 都不能与水电离出的OH-或 H+结合生成弱电解质,所以强酸强碱盐不能水解,不会破坏水的电离平衡,因此其溶液显中性。
[总结]盐类水解的类型和规律:
(1)强碱弱酸盐水解,溶液呈_____性,PH____7。如CH3COONa、______、______等。原因是_______与水电离出的___结合生成_______.从而使溶液中c(H+) ,c(OH-) ,从而使c(OH-) c(H+),溶液呈 性。
(2)强酸弱碱盐水解,溶液呈_____性,PH ____7。如NH4Cl、______、______等。原因是_______与水电离出的___结合生成_______.从而使溶液中c(H+) ,c(OH-) ,从而使c(OH-) c(H+),溶液呈 性。
(3)强酸强碱盐不发生水解,溶液呈_____性,PH ____7。
(4)弱酸弱碱盐强烈水解,溶液的酸碱性取决于形成盐的酸和碱的相对强弱。
(5)弱酸酸式盐的水解。溶液液的酸碱性取决于酸式根离子的电离程度和水解程度的相对
大小。若电离程度_____水解程度,则溶液呈酸性。如NaHSO3、NaH2PO4等。若电离程度______
水解程度,则溶液呈碱性。如NaHCO3Na2HPO4等
总之,水解的规律是:有弱才水解,无弱不水解,越弱越水解,都弱双水解。谁强显谁性,同强显中性。
17.1958年世界上第一个心脏起搏器在瑞典植入人体成功,使用寿命长达10年之久.这种能源起搏器中安装了寿命最长、可靠性最高的锂-碳电池.这种电池容量大,电压稳定,能在-56.7-71.1℃温度范围内正常工作,现已在火箭、移动电话、笔记本电脑中广泛使用.它采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液.电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S.
(1)此电池中________作负极,电极反应为________,________作正极.
(2)该电池用于心脏起搏器时,在生理上的作用是________.
16.炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:
(1)铁锅的锈蚀应属于________,腐蚀的原因是________;
(2)铁锅锈蚀的电极反应式为:负极________,正极________.正负电极反应产物会继续发生反应,反应的离子方程式或化学方程式为________.
15.锂电池是新一代的高能电池,它以质轻、高能而受到普遍重视.目前已经研制成功了多种锂电池.某种锂电池的总反应可表示为:Li+MnO2=LiMnO2.若该电池提供5库仑(C)电量(其他损耗忽略不计),则消耗的正极材料的质量约为(相对分子质量和相对原子质量Li:7,MnO2:87,电子电量取1.60×10-19C)[ ]
A.3.5×103g B.7×10-4g C.4.52×10-3g D.4.52×10-2g
14.某原电池的电池反应为Fe+2Fe3+=3Fe2+,与此电池反应不符的原电池是[ ]
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3溶液组成的原电池
D.银片、铁片、Fe(NO3)3溶液组成的原电池
13.(2000上海)随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提上议事日程,其首要原因是[ ]
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
12.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是[ ]
A.在氧化一还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是负极
11.(2001试测)在锌片和盐酸的反应中,加入下列试剂,可使生成氢气的速率变慢的是[ ]
A.硫酸铜晶体 B.水 C.氯化钡晶体 D.醋酸钾晶体
10.将金属A和金属B分别放入稀H2SO4中均有氢气生成.若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀;B未被腐蚀.关于B的叙述正确的是[ ]
A.金属活动性A>B B.还原性B>A
C.在后者装置中金属A发生还原反应,金属B发生氧化反应
D.金属B的表面上明显有气泡产生,金属A表面无明显现象
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com