
1、依据物质反应的客观事实.
释例1:铁与稀盐酸反应:
2Fe+6H+=2Fe3++3H2↑(错误),正确的是:Fe+2H+=Fe2++H2↑.
6、两性氢氧化物的电离(以氢氧化铝为例):
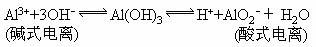
5、多元弱酸酸式盐:NaHCO3= HCO3-+Na+
4、多元强酸酸式盐一步书写到位:NaHSO4= SO42-+H++ Na+
3、多元弱碱,分步进行,但一步书写到位:Mg(OH)2 Mg2++2OH-
Mg2++2OH-
2、多元弱酸的分步电离,分步书写,且第一步电离为主,各步方程式不可叠加。
H2S HS-+H+
H3PO4
HS-+H+
H3PO4 H+ + H2PO4-
H+ + H2PO4-
1、电离方程式的书写:强电解质用“=”,弱电解质用“ ”
”
2、“强与弱”
(1)表解
|
|
强电解质 |
弱电解质 |
|
定义 |
在水溶液里全部电离成离子的电解质
|
在水溶液里只有一部分分子电离成离子的电解质
|
|
电离程度 |
完全 |
部分 |
|
电离条件 |
水或熔化 |
水 |
|
化合物种类 |
离子化合物,某些共价化合物 |
共价化合物 |
|
溶液里的粒子 |
离子 |
分子、离子 |
|
实例 |
强酸 强碱 大部分的盐 |
弱酸 弱碱和难溶性碱 水 |
(2)电解质溶液导电能力的强弱只取决于在相同条件下溶液中自由离子的浓度和其所带电荷的多少。
(3)难溶性盐(如CaCO3、BaSO4等)在水中的溶解度极小,导电能力很小,但由于它们是离子化合物,在水溶液中溶解的那部分能完全电离,故它们属于强电解质。 (4)溶液导电性的强弱与电解质的强弱没有必然的联系。导电能力强的溶液不一定是强电解质溶液,强电解质溶液不一定导电能力强。
1、“是与非”
(1)电解质概念中的或,两种情况任取一即可;非电解质概念中的无论和都,两种情况必须同时满足。 (2)无论是电解质还是非电解质,阐述的对象都是化合物。因此单质即不是电解质也不是非电解质。溶液是混合物,因此也即不是电解质也不是非电解质。 (3)氨气,二氧化硫溶于水均能导电,但并非它们本身能电离出自由离子,而是它们与水反应的生成物NH3•H2O、H2SO3能电离出离子而导电,所以氨气,二氧化硫都是非电解质。 (4)电离不需要通电,电离是电解质溶液导电的前提。 (5)能导电的物质不一定是电解质,如石墨等;电解质本身不一定能导电,如食盐晶体。 (6)电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数相等,故溶液显电中性,称电荷守恒。
14.为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及 (NH4)2SO4和NH4HSO4固体。为测定上述(NH4)2SO4和NH4HSO固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH 溶液的体积/Ml |
氨气的体积/L |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(1)实验过程中有关反应的离子方程式为_______________________;
(2)由Ⅰ组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为__________________L;
(3)试计算该混合物(NH4)2SO4和NH4HSO4的物质的量之比;
(4)欲计算该NaOH溶液的物质的量浓度应选择第____________组数据,由此求得NaOH溶液的物质的量浓度为______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com