
8.(14分,每空2分)(1)①2OH-+CO2==CO32-+H2O ② AC
(2)①c(Na+)>c(AlO2-)>c(OH-)>c(H+) ②Al3++3AlO2-+6H2O==4Al(OH)3↓
 (3)①2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
(3)①2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
②离子键和极性键(或共价键)
③用湿润的红色石蕊试纸,若变蓝则证明为氨气
8.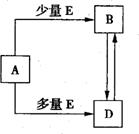 (14分)已知A、B、D、E均为中学化学常见单质或化合
(14分)已知A、B、D、E均为中学化学常见单质或化合
物,它们之间的关系如图所示(部分产物略去)。
(1)若A、B、D的焰色反应均为黄色,且E为一种酸性的温室气体。
①写出A溶液→B溶液的离子方程式 。
②下面关于化合物A、B、D的说法正确的是 。
A.等物质的量的D与A均匀混合加热最后可得纯净物
B.用稀盐酸和澄清石灰水及相应的仪器即可检验D溶液中是否含B
C.用A溶液即可鉴别CuSO4、FeCl2、Fe2(SO4)3、Al(NO3)3、KAlO2溶液
D.往28.6 g B·10H2O晶体中缓慢加入10 ml 1mo1·L-1H2SO4可得22.4L气体E
(2)若A为一种金属的盐酸盐RCl3,R与盐酸或氢氧化钠溶液反应均产生氢气。
①写出R与氢氧化钠溶液恰好反应得到的溶液中离子浓度的大小顺序 。
②写出A溶液与D溶液反应的离子方程式 。
(3)若A与D相遇会产生白烟,则
①实验室制取A的化学方程式为 。
②B中的化学键类型为 。
③检验A的方法及结论为 。
7.下列离子方程式书写正确的是 ( B )
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:
Ca2++2HCO3-+2OH-=CaCO3¯+2H2O+CO32-
B.向NaAlO2溶液中加盐酸至溶液呈酸性:A1O2-+4H+=Al3++2H2O
C.向碳酸氢铵溶液中加入过量的NaOH溶液:HCO3-+OH-=CO32-+H2O
D.Cl2与H2O反应:Cl2+H2O=2H++Cl-+C1O-
6. 在溶液中加入盐酸后仍能大量共存的离子组是( C ) A.Fe2+、Na+、NO3-、Cl- B.Ba2+、K+、Cl-、SO42-
C. NH4+、Mg2+、I-、SO42- D.Na+、NH4+、AlO2-、Cl-
5. 在一定条件下,ROn-3与R2-发生如下反应:
在一定条件下,ROn-3与R2-发生如下反应: ROn-3+2R2-+6H+=3R+3H2O下列关于元素R的叙述中正确的是 ( C )
ROn-3+2R2-+6H+=3R+3H2O下列关于元素R的叙述中正确的是 ( C )
 A.R原子的最外层上有4个电子
A.R原子的最外层上有4个电子
 B.ROn-3中的R只能被还原
B.ROn-3中的R只能被还原
 C.R的单质既有氧化性义又有还原性
C.R的单质既有氧化性义又有还原性
 D.HnRO3一定是强酸
D.HnRO3一定是强酸
4.用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( C )
A.2.24 L CO2与足量的Na2O2反应,Na2O2转移的电子总数为0.1NA
B.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA
C.电解精炼铜时转移了NA个电子,阴极析出32 g铜
D.100 mL 1 moL/L FeCl3溶液中含阳离子数小于0.1NA
3.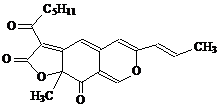 红曲色素是通过中国传统工业发酵得到的天然色素,用于食品色素安全性很高,同时具有抑菌、防腐和保健作用。其中一种成分红斑红素结构如图所示,下列有关红斑红素的说法正确的是D
红曲色素是通过中国传统工业发酵得到的天然色素,用于食品色素安全性很高,同时具有抑菌、防腐和保健作用。其中一种成分红斑红素结构如图所示,下列有关红斑红素的说法正确的是D
A. 分子中环上的所有原子都在同一平面上
B. 既能发生银镜反应,又能被氢气还原
 C. 1 mol 该物质水解时能消耗2 mol NaOH
C. 1 mol 该物质水解时能消耗2 mol NaOH
 D.
1 mol该物质能与5 mol Br2发生加成反应
D.
1 mol该物质能与5 mol Br2发生加成反应
2.对于达到平衡的可逆反应:A(g)+3B(g) 2C(g);△H<0,下列说法正确的是B
2C(g);△H<0,下列说法正确的是B
A.降低温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.在一定温度下,减小压强,平衡向逆反应方向移动,B的浓度增大
C.在恒温、恒容条件下,向平衡体系中加入A物质,C的体积分数增加
D.在恒温、恒压条件下,将平衡体系中各物质的物质的量均减少一半,平衡不移动
1.现有甲、乙、丙、丁四种金属,为了判断其活泼性强弱,某同学设计了下列实验:
①甲、乙在氢氧化钠溶液中构成原电池,根据气泡产生的电极,确定甲、乙活泼性
②将等物质的量的丙、丁放入稀硫酸中,比较产生氢气的量,比较丙、丁活泼性
③用石墨为电极,电解等物质的量浓度的乙、丁的硫酸盐溶液,根据阴极先析出金属判断乙、丁活泼性
④将甲单质投入丙的盐溶液中,根据是否置换丙单质判断甲、丙的活泼性
上述实验能达到目的的是( C )
A.①④ B. ②③ C. ③ D.④
[例1] 下列各组离子可能大量共存的是 ( )
A.不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2-
B.能与金属铝反应放出氢气的溶液中: K+、NO3-、Cl-、NH4+
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32-
D.含有HCO3-的溶液中:K+、OH-、NO3-、Ca2+
[例2] 下列各组离子一定能大量共存的是 ( )
A.含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
[例3] 某溶液中含三种离子,加入过量氨水有沉淀生成,过滤后滤液中加过量盐酸,又有沉淀生成,再过滤,滤液中加入过量Na2CO3溶液,仍有沉淀生成,原溶液中含有的离子可能是 ( )
A.Ag+ Fe2+ Ca2+ B.Al3+ Mg2+ Ba2+
C.Ca2+ Fe2+ Ba2+ D.Ag+ Mg2+ Ba2+
[例4] 25℃时,在含有大量Ba2+的某澄清透明溶液中,由水电离产生的OH-物质的量浓度为1×10-12mol/L,则在此溶液中还可能大量共存的离子组有 ( )
A.Na+、Fe2+、NO3- B.K+、CH3COO-、SO42-
C.NH4+、HCO3-、SCN- D.Cu2+、Mg2+、Cl-
[例5] 某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;⑵在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;⑶在⑵所得溶液中加入过量Ba(OH)2溶液,也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的是
A.Al3+ B.Na+ C.SO42- D.CO32-
[例6] 下列离子方程式书写正确的是 ( )
A.用碳酸钠稀溶液吸收少量二氧化碳:CO32-+CO2+H2O=2 HCO3-
B.向小苏打溶液中加入醋酸:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
C.向硫酸氢钠溶液中加入少量氢氧化钠:H++OH-=H2O
D.向FeBr2溶液中加入过量的氯水:2Fe2++2Br-+2Cl2=Br2+4Cl-+2Fe3+
[例7] 下列离子方程式书写正确的是 ( )
A.向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-=== CaCO3↓+CO32-+2H2O
B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-===2I2+2H2O
C.次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O=2HClO+SO32-
D.硫化钠的水解反应:S2-+H3O+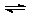 HS-+H2O
HS-+H2O
[例8] 下列反应的离子方程式正确的是 ( )
① 亚硫酸钠溶液中加入硝酸:SO32-+2H+=H2O+SO2↑
② 铜片跟浓硝酸反应:Cu + 2NO3-+4H+=Cu2++2NO2↑+2H2O
③ 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3·H2O+H2O
④ 0.1molFeBr2中通入0.1mol Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2 +6Cl-
|
 H2S+2OH-
H2S+2OH-
⑥ 向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO 3-
A.①②③ B.②③⑥
C.③④⑥ D.④⑤⑥
[例9] 下列反应的离子方程式错误的是 ( )
A.硫酸铝中加入过量浓氨水:Al3++4OH-=AlO2-+2H2O
B.铜跟浓硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
C.实验室用大理石跟稀盐酸反应制二氧化碳气体:CO32-+2H+=CO2↑+H2O
D.用氯化铁溶液制作印刷电路板:Cu+2Fe3+=Cu2++2Fe2+
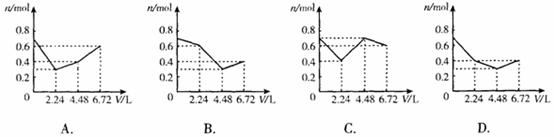
[例10] 往含0.2mol KOH和0.1mol Ca(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解忽略不计) (D)
[例11] 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、 I-、Mg2+、Ba2+、SO42-、CO32-、NO3-,现取二份各100 mL溶液进行如下实验:
①第一份加足量NaHCO3 溶液加热后,收集到气体0.05 mol
②第二份加足量Ba(NO3)2 溶液充分反应后过滤干燥,得沉淀4.66 g。
根据上述实验回答
(1)溶液中一定不存在的离子是 ;
(2)溶液中可能存的离子是 ;
(3)请写出溶液中一定存在的阴离子的物质的量浓度 。
[例12]100mL某无色透明溶液中可能含有Fe3+、Ag+、Al3+、Ba2+、Mg2+、K+、Na+等阳离子。进行下述实验(所加试剂均过量)

(1)根据上图推断:溶液中一定存在的阳离子除Al3+和Mg2+外还有 ;溶液中一定还大量存在阴离子,则其可能是 ;
(2)反应①、②的离子方程式分别为:
①
②
(3)若实验中测得白色沉淀C和固体F的质量分别为13.6g和5.1g,则原溶液中Mg2+离子的物质的量浓度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com