
7.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是
A.Sn B.Zn C.Cu D.Ag
6.干电池使用时,发生的化学反应类型属下列中的
A.中和反应 B.氧化还原反应 C.分解反应 D.电解反应
5.某金属A不溶于冷的浓硝酸,A与银用导线连接后浸入硫酸溶液,所组成的原电池中电流由银通过导线流回A极,则A可能是
A.Pt B.Cu C.A1 D.Fe
4.在下列各种变化中,属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层
B.白铁(镀锌铁)表面有划损时,也能阻止铁被氧化
C.红热的铁丝与水接触表面形成蓝黑色的保护层
D.铁与稀硫酸反应时,加入少量硫酸铜溶液后可使反应加速
3.对原电池的电极名称,下列叙述中错误的是
A.电子流入的一极为正极 B.比较不活泼的一极为正极
C.电子流出的一极为负极 D.发生氧化反应的一极为正极
2.由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的酸性
A.不变 B.先变小,后变大
C.逐渐变大 D.逐渐变小
1.有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液,B不易腐蚀。将A、D在稀盐酸中构成原电池,电流由A通过导线流向D。将铜浸入B的盐溶液中,无明显变化。如果把铜浸入C的盐溶液中,有金属C析出。这四种金属的活动性由强到弱的顺序是
A.DCAB B.DABC C.DBAC D.BADC
9.人体内葡萄糖氧化作用可以用以下热化学方程式表示:
C6H12O6(s)+6O2(g)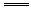 6CO2(g)+6H2O(l);△H=-2 804.6 kJ·mol-1。若每人每天需消耗热量12558kJ,则每人每天至少需要葡萄糖多少______g。
6CO2(g)+6H2O(l);△H=-2 804.6 kJ·mol-1。若每人每天需消耗热量12558kJ,则每人每天至少需要葡萄糖多少______g。
专题2 化学反应与能量变化
第3单元 化学能和电能的转化
课时4:化学能转化为电能
8.298K时,合成氨反应的反应热△H=-92.4 kJ·mol-1。在该温度下,取1mol N2和3mol H2放在一个密闭的容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_______________。
7.写出下列反应的热化学方程式。
(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量
________________________________________________________________
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ
_______________________________________________________________
(3)10g CaCO3分解吸收热量17.56kJ
_______________________________________________________________
(4)10g 乙烷(C2H6)气体完全燃烧生成液态水放出热量520.32kJ
_______________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com