
4. 用二根铂丝作电极插入KOH溶液中,分别向两极通入甲烷和氧气,可作为一种燃料电池的模拟装置。试判断下列说法正确的是
(A) 通氧气的铂极为负极
 (B) 此电池反应为CH4 + 2O2 CO2
+ 2H2O
(B) 此电池反应为CH4 + 2O2 CO2
+ 2H2O
(C) 此电池放电时,KOH浓度不变。
(D) 此电池放电时,KOH浓度减小。
3. 用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL0.3molL-1 NaCl溶液和300ml0.3molL-1的AgNO3溶液,当产生0.56L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL)
用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL0.3molL-1 NaCl溶液和300ml0.3molL-1的AgNO3溶液,当产生0.56L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL)
A.1.4 B.5.6 C.7 D.12.6
2. 在一定温度下,以惰性电极电解硫酸钾饱和溶液,当阳极产生a摩气体时,溶液中析出W 克晶体(不含结晶水),设电解过程中温度保持不变,则剩余溶液的溶质的质量分数为
A. B.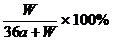 C.
C.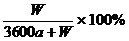 D.
D.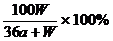
1. ①白铁(铁上镀锌)②马口铁(铁上镀锡)③铜质奖章(铁上镀铜),当镀层破坏后,铁腐蚀速率由快到慢的顺序是
A.③①② B.②①③ C.③②① D.①②③
18.(09宁夏卷 37)[化学-选修化学与技术](15分)
37)[化学-选修化学与技术](15分)
 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)

 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过

 ①
①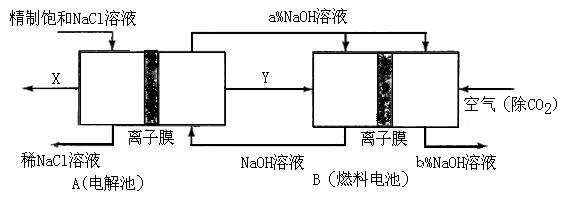 图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
 ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
 答案:
答案:
(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89
(2)③①②
 (3)①Cl2 H2 a%小于b%
②O2+4e-+2H2O=4OH-
H2-2e-+2OH-=2H2O ③燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗(其他合理答案也给分)
(3)①Cl2 H2 a%小于b%
②O2+4e-+2H2O=4OH-
H2-2e-+2OH-=2H2O ③燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗(其他合理答案也给分)


 解析:
解析:
(1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89;
(2)只要抓住除钡离子要放在除碳酸根离子前即可得到顺序关系:③①②;
(3)本题突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2 ;再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的就是X,必然为Cl2了;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4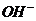 可知NaOH+浓度增大
可知NaOH+浓度增大

17.(09海南卷 15)(9分)
15)(9分)
 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;

 (2)电池正极发生的电极反应为
;
(2)电池正极发生的电极反应为
;
 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为 ;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
答案:
 (1)锂
(1)锂
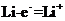 (2分)
(2分)
 (2)
(2)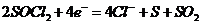 (2分)
(2分)
 (3)出现白雾,有刺激性气体生成
(3)出现白雾,有刺激性气体生成 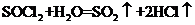 (3分)
(3分)
 (4)锂是活泼金属,易与
(4)锂是活泼金属,易与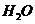 、
、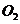 反应;
反应;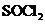 也可与水反应(2分)
也可与水反应(2分)
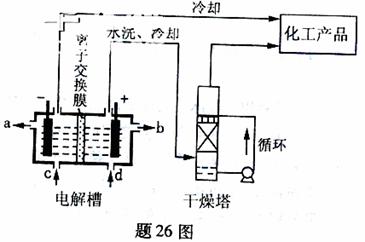
16. (09重庆卷26)(14分)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅
(1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为 (填字母);干燥塔中应使用的液体是 。

(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为 。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
 3 SiCl4(g)+2H2(g)+Si(s)
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
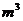 (标准状况)
(标准状况)
答案:
(1)①氯气;a;d;浓硫酸
(2)①SiCl4+2H2+O2 SiO2+4HCl②0.35
SiO2+4HCl②0.35
(3)134.4
解析:
(1)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-===Cl2↑;阴极:2H++2e-===H2↑;总反应为:2NaCl+2H2O Cl2↑+H2↑+2NaOH。H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,选d;要干燥Cl2需要用酸性干燥剂H2SO4或P2O5等,中性干燥剂无水CaCl2。
Cl2↑+H2↑+2NaOH。H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,选d;要干燥Cl2需要用酸性干燥剂H2SO4或P2O5等,中性干燥剂无水CaCl2。
(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可。发生的化学方程式为:SiCl4+2H2+O2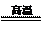 SiO2+4HCl。
SiO2+4HCl。
②
由3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
起始量(mol) n 0
变化量(mol) 3x 2x x 4x
 平衡量(mol)
n-2x
4x
平衡量(mol)
n-2x
4x
4x=0.020mol/L×20L=0.4mol,n-2x=0.140mol/L20L=2.8mol,n=3.0mol,由2NaCl+2H2O Cl2↑+H2↑+2NaOH,(2×58.5)g:1mol=m(NaCl)g:3mol;m(NaCl)=351g=0.351kg。
Cl2↑+H2↑+2NaOH,(2×58.5)g:1mol=m(NaCl)g:3mol;m(NaCl)=351g=0.351kg。
(3)由NaCl转化为NaClO3,失去电子数为6,H2O转化为H2,得到的电子数为2,设产生的H2体积为V,由得失电子守恒有:
 6×
6×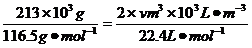 ;V=134.4m3。
;V=134.4m3。
15.(09山东卷 29)(12分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
29)(12分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。

 (1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
 a.NaOH b.Zn c.Fe d.NH3·H2O
a.NaOH b.Zn c.Fe d.NH3·H2O
 (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是

 。若电解电路中通过2mol电子,MnO2的理论产量为 。
。若电解电路中通过2mol电子,MnO2的理论产量为 。
 答案:
答案:
(1)Zn(或锌) 正极
(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀  b
b
(3)2H++2e-→H2 ,87g
 解析:
解析:
(1)负极上是失电子的一极 Zn失电子有负极经外电路流向正极。
(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。除杂的基本要求是不能引入新杂质,所以应选Zn将Cu2+ 置换为单质而除去
(3)阴极上得电子,发生还原反应, H+得电子生成氢气。因为MnSO4-MnO2-2 e-,通过2mol电子产生1molMnO2,质量为87g。
14. (09山东卷31)(8分)(化学-化学与技术)
(09山东卷31)(8分)(化学-化学与技术)
 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:
金属铝的生产是以Al2O3为原料,在熔融状态下进行电解: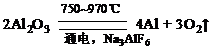 请回答下列问题:
请回答下列问题:
 (1)冰品石(Na3AlF6)的作用是 。
(1)冰品石(Na3AlF6)的作用是 。
 (2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。
(2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。
 (3)阴极和阳极均由 材料做成;电解时所消耗的电极是 (填“阳极”或“阴极”)。
(3)阴极和阳极均由 材料做成;电解时所消耗的电极是 (填“阳极”或“阴极”)。
 (4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。
 a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
 答案:
答案:
(1)降低Al2O3的熔化温度
 (2)下层
(2)下层
(3)碳棒(或石墨) 阳极
(4)c
 解析:
解析:
(1)Al2O3的熔点很高,熔化得需要较多能量,加入助熔剂就可节约能量,降低熔化温度
 (2)由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层。
(2)由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层。
 (3)电解时阳极的碳棒被生成的氧气氧化。
(3)电解时阳极的碳棒被生成的氧气氧化。
 (4)电解产生的铝要尽量以单质形式存在,所以将回收铝做成铝锭最好。
(4)电解产生的铝要尽量以单质形式存在,所以将回收铝做成铝锭最好。
13.(09全国卷Ⅰ28)(15分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g
10.00%的K2SO4溶液,电极均为石墨电极
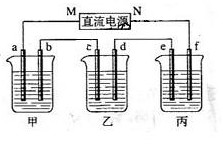
(1) 接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
答案:
(1)①正极 ②4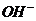 -4e-=2H2O + O2↑。③2.8L
④16g
⑤甲增大,因为相当于电解水;乙减小,
-4e-=2H2O + O2↑。③2.8L
④16g
⑤甲增大,因为相当于电解水;乙减小,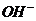 放电, H+增多。丙不变,相当于电解水。
放电, H+增多。丙不变,相当于电解水。
(2)可以 因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
解析:

 (1)①乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2
(1)①乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2  2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2
×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2
×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com