
6.某结晶水合物的化学式为R·nH2O,其式量为M,25℃时将a g该晶体溶于b g水中达到饱和,并变成V mL溶液,下列表达式正确的是
A.饱和溶液的物质的量浓度为1000a(M-18n)/MV mol·L-1
B.饱和溶液的溶质的质量分数为a(M-18n)/100M(a+b)?
C.25℃时R的溶解度为100a(M-18n)/(18na+Mb) g
D.饱和溶液的密度为a(M-18n)/(a+b) g·L-1
5.已知常温下Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16.将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量AgNO3固体,下列说法不正确的是
A.两清液混合后,AgCl,AgI都沉淀,
B.两清液混合后,只有AgI沉淀
C.若AgNO3固体足量,可能AgCl,AgI都沉淀,以AgCl为主
D.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
4.某氯化镁溶液的密度为1.18g•cm-1 ,其中镁离子的质量分数为5.1%。300mL该溶液中Cl-离子的物质的量约等于
A.0.37mol B. 0.63mol C. 0.74mol D.1.5mol
3.25℃时,水的电离达到平衡:H2O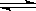 H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
2. 在100 mL 0.10 mol/L的 AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.010 mol CuSO4·5H2O的溶液,充分反应。下列说法中正确的是
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02 mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.10 mol/L
1.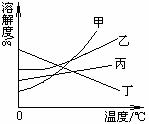 我国西北部有许多盐碱湖,湖水中有大量的NaCl和Na2CO3,那里的人们冬天捞碱,夏天晒盐。据此,你认为图中________的溶解度曲线与纯碱的溶解度曲线最相似。
我国西北部有许多盐碱湖,湖水中有大量的NaCl和Na2CO3,那里的人们冬天捞碱,夏天晒盐。据此,你认为图中________的溶解度曲线与纯碱的溶解度曲线最相似。
A.甲 B.乙
C.丙 D.丁
4.阿伏加德罗常数(NA)、物质的量(n)和粒子数(N)之间有如下关系:NA=N / n。测定阿伏加德罗常数有多种方法,其中电解法是常用的方法。试回答下列有关问题。
(1)现实验室有同样浓度的氯化钠、硫酸铜、硝酸银、硫酸等溶液。若实验过程中不考虑电极上的析出物质与电解后的溶液之间的反应,则你认为选用哪一种溶液作为电解液,实验既简便、测定结果误差又小,并说明理由______________________________________。
(2)采用你所选定的溶液来实验,至少应测定哪些数据?___________________________。
(3)若已知1个电子的电量为q,选定符号代表有关物理量,列出计算阿伏加德罗常数(NA)的数学表达式。
[课后巩固]
3. 根据下图所示,A、B、C、D四种物质的溶解度曲线,完成下列问题:
根据下图所示,A、B、C、D四种物质的溶解度曲线,完成下列问题:
(1)当温度高于0℃低于t1℃时,四种物质溶解度由大到小的顺序是________。
(2)温度在________℃时,B、D两物质溶解度相等。
(3)随温度升高,D物质溶解度________。
(4)要想得到四种物质的晶体,A、B采取________方法,C采取________方法,D采取________方法,分离A、C可用________方法。
2. 将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A.Ca(OH)2的溶解度、溶剂的质量
B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡
D.溶液中Ca2+的数目、Ca(OH)2的溶解平衡
1.20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为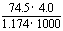 ×100%
×100%
C.20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com