
在其它条件不变的情况下,增加反应物的浓度或减少生成物的浓度,化学平衡向着正反应方向移动;增加生成物的浓度或减少反应物的浓度,化学平衡向着逆反应的方向移动。
在可逆反应中,为了尽可能利用某一反应物,经常用过量的另一种物质和它作用。
不断将生成物从反应体系中分离出来,则平衡将不断向生成产物的方向移动。
2.5 化学平衡的移动
2. 化学平衡常数
(1)实验平衡常数
在一定温度下液相达平衡时,都能建立如下的关系式
aA + bB 
 dD + eE
dD + eE
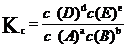
Kc为浓度平衡常数。
对气体反应,还可用气体的分压代替浓度。平衡常数表达式可写成Kp,
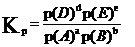
Kc 、Kp统称为实验平衡常数。
(2)标准平衡常数(热力学平衡常数)
l 标准平衡常数表达式
对溶液中的反应:aA(S)+bB
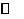 eE+ dD
eE+ dD
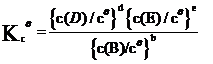 (固体A不参与此式的书写)
(固体A不参与此式的书写)
对气相反应要用分压表示
(3)书写和应用平衡常数的几点说明:
①平衡常数表达式需与计量方程式相对应,同一化学反应用不同计量方程式表示时,平衡常数表达式不同,得到的数值也不同。
例 N2 (g) + 3 H2
(g)  2NH3 (g)
2NH3 (g)
K1 = 1.60 ´ 10 -5
1/2N2 (g) + 3/2 H2
(g)  NH3 (g)
NH3 (g)
K2 = 3.87 ´ 10 -2
K1 ¹ K2 , K1 = K22
②纯固体与纯液态及水溶液中参加反应的水的浓度在平衡常数表达式中不出现;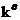
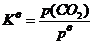 例: Ca2CO3 (s)
例: Ca2CO3 (s)  CaO(s) + CO2
CaO(s) + CO2
③ 写入平衡常数表达式中各物质的浓度或分压,必须是在系统达到平衡状态时相应的值。气体只可用分压表示。
④ 温度发生改变,化学反应的平衡常数也随之改变,因此,在使用时须注意相应的温度。
●平衡常数的意义
①平衡常数是可逆反应的特征常数。对同类反应来说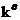 越大,反应进行得越完全。
越大,反应进行得越完全。
②由平衡常数可以判断反应是否处于平衡态和非平衡态时反应进行的方向。
●多种平衡的平衡常数
多重平衡的规则:在相同条件下,如有连个反应方程式相加或相减得到第三个反应方程式,则第三个反应方程式的平衡常数为前两个反应方程式平衡常数之积或之商。
即 K3 = K1 × K2 或 K3 = K1/K2
3 .平衡常数与平衡转化率
转化率 :
a = 某反应物已转化的量/某反应物的重量×100%
若反应前后体积不变,反应的量可以用浓度表示
a =(某反应物的起始浓度 - 某反应物的平衡浓度)/某反应物的起始浓度×100%
1. 化学平衡及特征
在一定条件下,既能向正方向进行又能向逆方向进行的反应称可逆反应。如反应:CO(g)+H2O(g)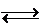 H2(g)+CO2(g)
H2(g)+CO2(g)
在高温下CO与H2O能反应生成H2和CO2,同时H2与CO2也能反应生成CO和H2O。对这样的反应,为强调可逆性,在反应式中常用 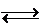 代替等号。
代替等号。
化学平衡及特征:


几乎所有反应都是可逆的,只是有些反应在已知的条件下逆反应进行的程度极为微小,以致可以忽略,这样的反应通常称之为不可逆。如KClO3加热分解便是不可逆反应的例子。
可逆反应在进行到一定程度,便会建立起平衡。例如,一定温度下,将一定量的CO和H2O加入到一个密闭容器中。反应开始时,CO和H2O的浓度较大,正反应速率较大。一旦有CO2和H2生成,就产生逆反应。开始时逆反应速率较小,随着反应进行,反应物的浓度减少,生成物的浓度逐渐增大。正反应速率逐渐减少,逆反应速率逐渐增大。当正、逆反应速率相等时,即达到平衡状态。正、逆反应速率相等时的状态叫做化学平衡。
化学平衡有两个特征:
(1)化学平衡是一种动态平衡。表面上看来反应似乎已停止,实际上正逆反应仍在进行,只是单位时间内,反应物因正反应消耗的分子数恰等于由逆反应生成的分子数。
(2)化学平衡是暂时的、有条件的平衡。当外界条件改变时,原有的平衡即被破坏,直到在新的条件下建立新的平衡。
2.4 化学平衡
2.特点:
⑴ 高效性(用量少,作用大) ⑵ 选择性
一种催化剂只能催化一种或几种反应;同一反应用不同催化剂得到不同产物。
⑶ 反应前后组成和质量不变
⑷ 酶的活性要在一定温度、一定pH范围时才最大。
催化剂能改变反应速率的作用叫催化作用。
正催化:加速反应速率 负催化:减慢反应速率
1.催化剂影响反应速率的原因
催化作用的实质是改变了反应的机理,降低了反应的活化能,因而提高了反应速率。不改变反应前后物质的组成和质量,也不改变平衡常数K;缩短平衡到达的时间,加快平衡的到来。
范特霍夫规则
一般情况下:在一定温度范围内,对化学反应温度每升高10度反应速率大约增加到原来的2~4倍。
温度升高使反应速率显著提高的原因是:升温是反应物分子的能量增加,大量的非活化分子获得能量后变成活化分子,单位体积内活化分子的百分数大大增加,由小碰撞次数增多,从而反应速率明显增大。
2.基元反应的化学反应速率方程式:可由质量作用定律描述。
在一定温度下,对某一基元反应, 反应速率与各反应物浓度(以化学方程式中该物质的计量数为指数)的乘积成正比
如:aA + bB = gG + dD 为基元反应,
则: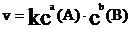
称作质量作用定律数学表达式。
而对于非基元反应,有:
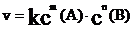
称作反应速率方程式。其中m、n要通过实验来确定。
(a+b)或(m+n)称为反应级数。
例1 S2O8 2- + 3I- = 2SO42- + I3- 非基元反应
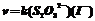
该反应为2级反应。
k 称为反应速率常数, 可用来表征反应的速率。
k与温度、催化剂有关,而与浓度无关。对于n级反应其单位是(molždm-3)(n-1)žs-1
反应级数的意义:
① 表示了反应速率与物质的量浓度的关系;
②零级反应表示了反应速率与反应物浓度无关
速率常数的单位
零级反应: u = k(cA)0 k的量纲为mol·dm-3·s-1
一级反应:u = kcA; k的量纲为s-1
二级反应:u = k(cA)2 k的量纲为mol3·dm-1·s-1
气体反应可用气体分压表示
2NO2 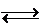 2NO +
O2;
2NO +
O2;
v = kc c(NO2 )2 ;或 v = kpp(NO2 )2; kc ¹ kP
1.基元反应: 对于简单反应,反应物分子在有效碰撞中经过一次化学变化就能转化为产物的反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com