
3. 1999年度诺贝尔化学奖授予开创“飞秒(10-15s)化学”新领域的科学家泽维尔,诺贝尔奖委员会对该技术的评语是:“使运用激光光谱技术观测化学反应时分子中原子运动成为可能”。你认为该技术不能观测到的是
A.原子中原子核的内部结构
B.化学反应中原子的运动
C.化学反应中生成物粒子的形成
D.化学反应中反应物粒子的分解
2. 用化学方法不能实现的是 ( )
 A.生成一种新分子 B.生成一种新离子
A.生成一种新分子 B.生成一种新离子
C.生成一种新原子 D.生成一种新单质
1. 元素的种类和原子的种类 ( )
A.前者大 B.后者大 C.相等 D.不能确定
4. 核素、同位素
核素:具有一定质子数和一定中子数的某种原子
同位素:质子数相同而质量数(或中子数)不同原子的互称
H: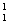 H
H 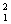 H(D)
H(D) 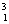 H(T) 氢元素有三种核素,三种核素间互称同位素。
H(T) 氢元素有三种核素,三种核素间互称同位素。
元素的相对原子质量: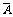 =A1×a1%+A2×a2%+……
=A1×a1%+A2×a2%+……
A1、A2……为核素的相对原子质量
a1%、a2%……为核素的原子百分数或核素原子的物质的量分数
例题解析
例1 下列关于原子的说法中,正确的是 ( )
A. 原子不显电性,说明原子内的质子数等于中子数
 B. 同种原子内的质子数相同
B. 同种原子内的质子数相同
C. 含有相同中子数的原子,一定是同一类的原子
D. 原子是最小的粒子
 分析:原子只是化学变化中的最小粒子,而构成原子的质子、中子和电子都比原子小,故D错。原子之所以不显电性,是由于原子核内的质子数等于核外电子数,故A错。原子的种类由质子数决定,同种原子当然具有相同数目的质子数,而如果只知中子数相同,不知质子数相同,则无法判断是否为同一类原子。故B对C错。
分析:原子只是化学变化中的最小粒子,而构成原子的质子、中子和电子都比原子小,故D错。原子之所以不显电性,是由于原子核内的质子数等于核外电子数,故A错。原子的种类由质子数决定,同种原子当然具有相同数目的质子数,而如果只知中子数相同,不知质子数相同,则无法判断是否为同一类原子。故B对C错。
例2 某元素一种同位素原子的质子数为m,中子数为n,则下述论断正确的是
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳原子质量为W克;此原子的质量为(m+n)W克
D.核内中子的总质量小于质子的总质量
分析:本题设置的意图在于考查对相对原子质量的认识。相对原子质量是化学科学中最基本的概念之一,要学会区分元素的相对原子质量与原子的(核素)相对原子质量;同位素的相对原子质量与同位素的质量数等概念的差异性。相对原子质量全称是元素的平均相对原子质量,不是某一个原子的相对原子质量,因此选项B看上去似乎是正确的,实际是错误的。任一原子的质量不可能是碳原子质量与此原子质子与中子数之和的乘积,而且碳原子有多种同位素,选项C中的W是没有被指定的数值,只从这一点来看,选项C也不能成立。题目没有指明是哪种核素,无法确切知道此核内质子数与中子数的相对多少,故选项D也不对。答案为A。
例3 (1)原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”。已知铱的一种同位素是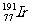 ,则其核内的中子数是
A.77 B.114 C.191 D.268
,则其核内的中子数是
A.77 B.114 C.191 D.268
(2)已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为 A.39∶61 B.61∶39 C.1∶1 D.39∶11
分析:本题将以当年科技界的一个惨痛的焦点问题:“铱星计划”因缺乏市场需求,曲高和寡,不得不宣布破产为背景,对考生进行有关原子结构知识的考查,使学生在解答问题的同时也在深深的思考“科技应如何转化为生产力”,对学生将来进入社会更好的发挥能力起到很好的警示作用。
第1问,由质量数=质子数+中子数 得:其核内的中子数=191-77=114,B正确;
第2问,常见的解法:设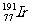 的原子个数百分比为x%,则有:
的原子个数百分比为x%,则有:
191×x%+193×(1-x%)=192.22,
解得:x%=39%
故答案为 1、B 2、A
 习题精练
习题精练
3. 有关原子结构常用规律总结
⑴ 质量关系:质量数(A)=质子数(Z)+中子数(N)
⑵ 电性关系:原子:核电荷数=质子数=核外电子数
阴离子:质子数=核外电子数-电荷数
阳离子:质子数=核外电子数+电荷数
2.几个概念:
原子质量:即原子的真实质量也称原子的绝对质量。单位 kg
粒子相对质量: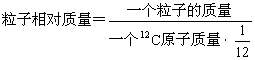
注:①单位 1(一般不写出)
②粒子:可以原子、质子、中子、电子、微观粒子
③质子、中子的相对质量约为1
质量数:原子中质量数与质子数得和
1. 原子的构成
原子的构成
|
|
电量 |
相对质量 |
实际体积 |
占据体积 |
||
原子 |
原子核 |
质子Z |
+1 |
1 |
小 |
小 |
|
中子N |
―― |
1 |
小 |
小 |
||
|
核外电子e- |
-1 |
1/1836 |
小 |
相对很大 |

对于多电子原子,可以近似认为原子核外电子是分层排布的;在化学反应中,原子核不发生变化,但原子的最外层电子会发生变化。
19. 有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0 mol·L-1 NaOH溶液反应,用去35mL碱液时恰好完全中和。试求混合液中H2SO4、HNO3的物质的量浓度各是多少?
有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0 mol·L-1 NaOH溶液反应,用去35mL碱液时恰好完全中和。试求混合液中H2SO4、HNO3的物质的量浓度各是多少?
18.实验室用如图所示方法制Fe(OH)2,但一般看不到白色的Fe(OH)2沉淀,原因是Fe(OH)2不稳定,极易被O2氧化生成Fe(OH)3,而由灰绿色转为红褐色的沉淀。反应的化学方程式: 4Fe(OH)2+O2+2H2O=4Fe(OH)3 。请回答:
(1)滴管下端插入液面下的原因是_____________________________。
(2)此反应中的O2可能来自于_____________________________。
(3)现欲用同样的装置制得Fe(OH)2白色沉淀(至少能存在较长的时间),设计一个改良的实验方案。(提示:如何能减少O2对生成Fe(OH)2的氧化,表格可不填满也可补充。)
|
操 作 方 法 |
目 的 |
|
|
|
|
|
|
|
|
|
 (4)实验探究:通过查阅资料,相互讨论,看看还可以如何设计实验,改进装置能制得白色的Fe(OH)2沉淀?
(4)实验探究:通过查阅资料,相互讨论,看看还可以如何设计实验,改进装置能制得白色的Fe(OH)2沉淀?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com