
1.需称量多少克Na2CO3固体?
2.将4gNaOH溶解在10mL水中,再稀释成1L,从中取出10mL,则取出的10mL溶液中NaOH的物质的量浓度是( )
A 1mol/L B 0.1mol/L C 0.01mol/L D 10mol/L
[问题解决]在工农业生产和科学研究中,经常需要精确配制一定物质的量浓度的溶液,现实验室急需100mL 1.0mol/L的Na2CO3溶液,你将准备如何配制?请你自主设计配制的简要步骤。
1.现欲用12mol/L的浓HNO3配制3mol/L的HNO3 100mL,则需取用多少毫升的浓HNO3 ?
2. 溶液稀释前后,溶质的物质的量不变。
公式: c浓 • V浓 = c稀 • V稀
[练习]
5.(展示矿泉水商标)假设某矿泉水中K+含量为27.3mg/L,则该矿泉水中钾离子的物质的量浓度为多少mol/L?
[实验] 将硫酸铜溶液倒出1/4,其质量分数变化吗?其物质的量浓度变化吗?若将其加水至原体积呢?
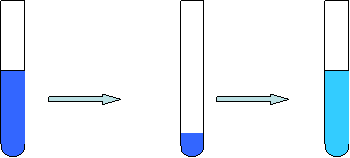
加水至与
取出1/4 原体积相同
|
溶液A 溶液B 溶液C
[分析] 溶液A中取出1/4,溶质的物质的量变成原来的1/4,即nB变成原来的1/4,同时体积变成原来的1/4,根据公式cB = nB/V液得出溶液的物质的量浓度不变;
向溶液B中加水至原体积,稀释过程中溶质的物质的量不变,体积变成原来的4倍,即nB不变,V变成原来的4倍,根据公式cB = nB/V得出溶液的物质的量浓度变成原来的1/4。
[结论] 1. 从溶液中取出一部分,物质的量浓度不变
4.10mol HCl能配成____L物质的量浓度为2mol/L的盐酸 ?
3.物质的量浓度为2mol/L的硫酸溶液500mL,含硫酸的物质的量为___mol。
2.标准状况下,22.4LHCl溶于水配成0.5L盐酸,其物质的量浓度为__mol/L。
[引入] 展示两瓶浓度不同的硫酸铜溶液。
两瓶硫酸铜溶液的颜色为什么会不相同?因为浓度不同。
展示不同商品的标签,如牛奶、矿泉水、啤酒、化验单等,引导学生关注上面浓度的表示方法。浓度的表示方法有多种,在初中我们学过溶质的质量分数。
溶质的质量分数= 溶质的质量/溶液的质量 ×100%
[过渡] CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 ,使0.1mol硫酸铜完全沉淀,需要多少氢氧化钠?
化学方程式中各物质前的系数体现了参加反应和反应生成的物质的什么量之比?物质的量。对溶液而言,是称其质量方便,还是量其体积方便?
许多化学反应是在溶液中进行的,生产和科学研究中经常要对溶液进行定量分析、定量计算,我们需要一个可以通过溶液体积直接计算溶质的物质的量的物理量。
[板书]物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表示溶液的组成的物理量,叫做溶质B的物质的量浓度。
符号:CB
单位:mol·L-1
表达式: cB=nB/V
[练习]
1.2molNaOH配成200mL溶液,其物质的量浓度为____mol/L。
本课设计从复习学生刚学过的“物质的量”知识引入,让学生了解定量分析在生产和科学研究中的作用,通过与溶液的质量分数的类比,引出“物质的量浓度”的概念,探究一定物质的量浓度溶液的配制,并在讨论中完善实验步骤和注意事项。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com