
6.定义在R上的偶函数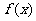 在
在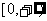 上递增,
上递增,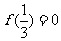 ,则满足
,则满足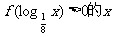 的取值范围是(
)
的取值范围是(
)
A.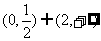 B.
B.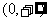 C.
C. 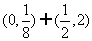 D.
D.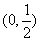
5.函数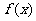 的反函数为
的反函数为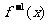 ,且
,且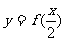 的图像与
的图像与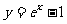 的图像关于
的图像关于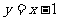 对称,则
对称,则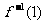 =( )
=( )
A.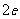 B.
B.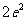 C.
C. 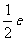 D.
D. 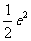
4.若命题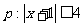 ,命题
,命题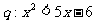 ,则
,则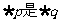 的( )
的( )
A.必要不充分条件 B.充分不必要条件
C.充要条件 D.既不充分也不必要条件
3.已知函数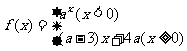 满足对任意
满足对任意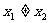 ,都有
,都有
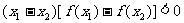 成立,则
成立,则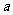 的取值范围为( )
的取值范围为( )
A.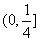 B.(0,1)
C.
B.(0,1)
C.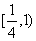 D.(0,3)
D.(0,3)
2.设复数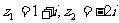 ,在复平面内对应的点分别为A,B,则A,B两点间的距离为(
)
,在复平面内对应的点分别为A,B,则A,B两点间的距离为(
)
A. 4
B.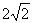 C.3
D.
C.3
D.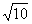
1.全集U={1,2,3,4},集合A={1,2},B={1,3},则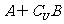 为(
)
为(
)
A. {1} B.{2} C.4 D.{1,2,4}
2.离子共存问题;
(1)在溶液中,若离子间能发生反应,如生成沉淀、弱电解质、气体的复分解反应,氧化还原反应,相互促进的水解反应,络合反应,则离子不能大量共存.
(2)注意隐性条件的限制,如颜色、溶液的酸碱环境、pH、因发生氧化还原反应、溶液中加铝产生的气体只有H2、水电离出的C(OH-)=1.0×10-10”等条件,将具体问题具体分析
1.条件不同时,相同反应物间的离子反应可能不同
(1)反应物的量不同,离子反应不同.如:
碳酸氢钙溶液与氢氧化钠溶液反应,若物质的量之比为1∶1时,离子反应方程式为Ca2++HCO3-+OH-=H2O +CO32-若二者物质的量之比为1∶2时,离子反应方程式为Ca2++ 2HCO3-+2OH-=CaCO3+2H2O +CO32- 因为不过量的物质会完全反应,所以在离子方程式中不过量的物质电离出的离子的计量数与其化学式中的计量数成比例.这是我们判断和书写此类离子方程式的依据.
(2)反应物滴加顺序不同,离子反应不同.如:
把氯化铝溶液逐滴加入到氢氧化钠溶液中,离子反应方程为A13++40H-=A102-+2H20.
若向氯化铝溶液中逐滴加入氢氧化钠溶液,离子反应方程式为Al3++3OH-=Al(OH)3 ↓ (3)反应条件不同,离子反应不同.如:
氯化铵溶液与氢氧化钠溶液混合,离子反应方程式为NH4++OH-=NH3·H20.
若氯化铵溶液与氢氧化钠溶液混合并加热,则离子反应方
NH4++OH- ?NH3↑+H2O
(4)微溶物状态不同,离子反应不同.如:
石灰乳与碳酸钠溶液混合,
若澄清石灰水与碳酸钠溶液混合,
3.判断一个离子反应是否正确的思维步骤
(1)看是否符合电离原理
酸、碱、盐是电解质,这三类物质才有可能写成离子形式,而不溶性的酸、碱、盐和弱酸、弱碱要写成化学式;单质、氧化物和气体必须写成化学式.如CaC03、BaS04、AgCl、H2Si03、 Cu(OH)2等不溶物要写成化学式,醋酸、氨水等弱电解质要写成化学式,微溶物处于溶液状态时应写离子,处于浊液或固体时应写化学式等.
(2)看是否符合实验事实
如:2Fe+6H+=2Fe2++3H2↑是错误的,因为H+只能将铁氧化成+2价;Cu+2H+=Cu2++H2↑是错误的,因为铜排在金属活动顺序表氢之后,不能置换出酸中的氢:Cu2++H2 ?Cu+ 2H+也中错误的,因为H2不可在水溶液中发生反应.
对未处于自由移动离子状态的反应不能写离子方程式,如铜与浓硫酸、氯化铵固体与氢氧化钙固体反应等.
(3)看反应物或产物的配比是否正确
如:稀硫酸与Ba(OH)2溶液反应不能写成H++OH-+Ba2++SO42-=H2O+BaSO4↓应写成2H++20H-+Ba2++SO42-=2H20+ BaSO4↓
(4)看反应物的用量
根据题设条件及要求,如“过量”、“少量”、“等物质的量”、“适量”、“任意量”以及滴加顺序等对离子反应方程式可能有影响.
(5)看是否遗漏掉参加反应的离子
如:Ba(OH)2溶液与硫酸铜溶液反应,既要考虑Ba2+与SO42-的离子反应,又要考虑Cu2+与OH-的离子反应,即Ba2++20H- + Cu2++ SO42-=BaSO4 ↓+Cu(OH)2↓.
(6)看电荷是否守恒、质量是否守恒
如:Fe3++Cu=Fe2++Cu2+中电荷不守恒.
(7)看符号的使用是否正确
对于“=”、“ ”、“↑”、“↓”符号使用要恰当,如:单弱离子水解反应式中的应改用可逆号,因为水解是可逆的,水解是微弱的;而Fe3++3H2O
?Fe(OH)3(胶体)+3H+中的可逆号应改为等号,因为在加热条件下水解进行得比较彻底.另外, Fe3+和A13+与弱酸根的促进水解反应应该用等号
”、“↑”、“↓”符号使用要恰当,如:单弱离子水解反应式中的应改用可逆号,因为水解是可逆的,水解是微弱的;而Fe3++3H2O
?Fe(OH)3(胶体)+3H+中的可逆号应改为等号,因为在加热条件下水解进行得比较彻底.另外, Fe3+和A13+与弱酸根的促进水解反应应该用等号
学以致用
2.要熟悉化学反应的一般规律,还要注意一些特例.如:K、 Ca、Na这些活泼金属置于某些不太活泼的金属盐溶液中主要是与水反应,而不是置换金属;金属与硝酸、浓硫酸反应不可能产生H2等.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com