
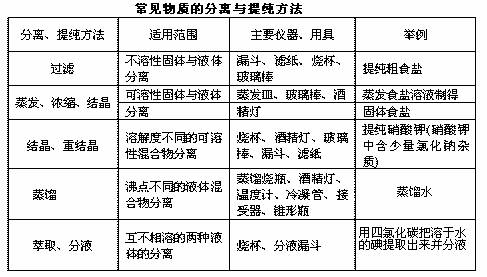
2、蒸馏操作应注意的事项:
①蒸馏烧瓶中所盛液体不能超过其容积的2/3,也不能少于1/3;
②温度计水银球部分应置于蒸馏烧瓶支管口下方约0.5cm处;
③冷凝管中冷却水从下口进,上口出;
④为防止爆沸可在蒸馏烧瓶中加入适量碎瓷片;
⑤蒸馏烧瓶的支管和伸入接液管的冷凝管必须穿过橡皮塞,以防止馏出液混入杂质;
⑥加热温度不能超过混合物中沸点最高物质的沸点。
过滤、蒸馏注意事项:
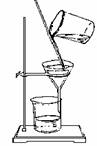
1、过滤操作应注意做到“一贴、二低、三接触”,如图:
①“一贴”:折叠后的滤纸放入漏斗后,用食指按住,加入少量蒸馏水润湿,使之紧贴在漏斗内壁,赶走纸和壁之间的气泡。
②“二低”:滤纸边缘应略低于漏斗边缘;加入漏斗中液体的液面应略低于滤纸的边缘(略低约 1cm),以防止未过滤的液体外溢。
③“三接触”:漏斗颈末端与承接滤液的烧杯内壁相接触;使滤液沿烧杯内壁流下;向漏斗中倾倒液体时,要使玻璃棒一端与滤纸三折部分轻轻接触;承接液体的烧杯嘴和玻璃棒接触,使欲过滤的液体在玻棒的引流下流向漏斗。过滤后如果溶液仍然浑浊,应重新过滤一遍。如果滤液对滤纸有腐蚀作用,一般可用石棉或玻璃丝代替滤纸。如果过滤是为了得到洁净的沉淀物,则需对沉淀物进行洗涤,方法是:向过滤器里加入适量蒸馏水,使水面浸没沉淀物,待水滤去后,再加水洗涤,连续洗几次,直至沉淀物洗净为止。
2.金属单质(Na、Mg、Al、Fe)的还原性
2Na+H2 2NaH 4Na+O2=2Na2O
2Na2O+O2△2Na2O2
2Na+O2
2NaH 4Na+O2=2Na2O
2Na2O+O2△2Na2O2
2Na+O2  Na2O2
2Na+S △Na2S(爆炸) 2Na+2H2O=2NaOH+H2↑
2Na+2NH3=2NaNH2+H2 4Na+TiCl4(熔融)△ 4NaCl+Ti
Mg+Cl2
Na2O2
2Na+S △Na2S(爆炸) 2Na+2H2O=2NaOH+H2↑
2Na+2NH3=2NaNH2+H2 4Na+TiCl4(熔融)△ 4NaCl+Ti
Mg+Cl2  MgCl2
Mg+Br2=MgBr2
2Mg+O2
MgCl2
Mg+Br2=MgBr2
2Mg+O2  2MgO
Mg+S △MgS
Mg+2H2O=Mg(OH)2+H2↑ 2Mg+TiCl4(熔融)
2MgO
Mg+S △MgS
Mg+2H2O=Mg(OH)2+H2↑ 2Mg+TiCl4(熔融) Ti+2MgCl2
Mg+2RbCl
Ti+2MgCl2
Mg+2RbCl MgCl2+2Rb 2Mg+CO2
MgCl2+2Rb 2Mg+CO2  2MgO+C
2Mg+SiO2
2MgO+C
2Mg+SiO2 2MgO+Si Mg+H2S=MgS+H2↑
Mg+H2SO4=MgSO4+H2 2Al+3Cl2
2MgO+Si Mg+H2S=MgS+H2↑
Mg+H2SO4=MgSO4+H2 2Al+3Cl2 2AlCl3
4Al+3O2=2Al2O3(钝化) 4Al+3MnO2
2AlCl3
4Al+3O2=2Al2O3(钝化) 4Al+3MnO2 2Al2O3+3Mn
2Al+Cr2O3
2Al2O3+3Mn
2Al+Cr2O3 Al2O3+2Cr 2Al+Fe2O3
Al2O3+2Cr 2Al+Fe2O3 Al2O3+2Fe
2Al+3FeO
Al2O3+2Fe
2Al+3FeO Al2O3+3Fe 2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH + 2H2O = 2NaAlO2+3H2↑
Al2O3+3Fe 2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH + 2H2O = 2NaAlO2+3H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
2Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2O (Al、Fe在冷、浓的H2SO4、HNO3中钝化) Al+6HNO3(浓)△Al(NO3)3+3NO2↑+3H2O Al+4HNO(稀)=Al(NO3)3+NO↑+2H2O
1。非金属单质(F2 、Cl2 、 O2 、 S、 N2 、 P 、 C 、 Si) (1)。氧化性: F2 + H2 = 2HF nF2 +2M=2MFn (表示大部分金属)
2F2 +2H2O=4HF+O2 F2 +Xe(过量)=XeF2
2F2(过量)+Xe=XeF4 2F2 +2NaOH=2NaF+OF2↑ +H2O
Cl2 +H2  2HCl 3Cl2
+2P
2HCl 3Cl2
+2P 2PCl3
Cl2 +PCl3 △PCl5 Cl2
+2Na=2NaCl
3Cl2 +2Fe
2PCl3
Cl2 +PCl3 △PCl5 Cl2
+2Na=2NaCl
3Cl2 +2Fe 2FeCl3 Cl2
+2FeCl2
=2FeCl3
Cl2+Cu
2FeCl3 Cl2
+2FeCl2
=2FeCl3
Cl2+Cu CuCl2 2Cl2+2NaBr=2NaCl+Br2
Cl2 +2NaI =2NaCl+I2 5Cl2+I2+6H2O=2HIO3+10HCl
Cl2 +Na2S=2NaCl+S Cl2
+H2S=2HCl+S
Cl2+SO2 +2H2O=H2SO4 +2HCl Cl2
+H2O2
=2HCl+O2
2O2 +3Fe
CuCl2 2Cl2+2NaBr=2NaCl+Br2
Cl2 +2NaI =2NaCl+I2 5Cl2+I2+6H2O=2HIO3+10HCl
Cl2 +Na2S=2NaCl+S Cl2
+H2S=2HCl+S
Cl2+SO2 +2H2O=H2SO4 +2HCl Cl2
+H2O2
=2HCl+O2
2O2 +3Fe  Fe3O4
O2+K
Fe3O4
O2+K KO2
S+H2△H2S 2S+C △CS2
KO2
S+H2△H2S 2S+C △CS2
S+Fe △ FeS S+2Cu △ Cu2S
3S+2Al △Al2S3 S+Zn △ZnS
N2+ 3H2 2NH3 N2+3Mg
2NH3 N2+3Mg  Mg3N2
N2+3Ca
Mg3N2
N2+3Ca  Ca3N2 N2+3Ba
Ca3N2 N2+3Ba  Ba3N2
N2+6Na
Ba3N2
N2+6Na 2Na3N N2+6K
2Na3N N2+6K  2K3N
N2+6Rb
2K3N
N2+6Rb 2Rb3N
P4+6H2△4PH3
2Rb3N
P4+6H2△4PH3
P+3Na△Na3P 2P+3Zn△Zn3P2
(2)还原性
S+O2 SO2 S+6HNO3(浓)△H2SO4+6NO2↑+2H2O
3S+4HNO3(稀)=3SO2+4NO↑+2H2O S+2H2SO4(浓)△3SO2↑+2H2O
N2+O2
SO2 S+6HNO3(浓)△H2SO4+6NO2↑+2H2O
3S+4HNO3(稀)=3SO2+4NO↑+2H2O S+2H2SO4(浓)△3SO2↑+2H2O
N2+O2 2NO 4P+5O2
2NO 4P+5O2 P4O10 (常写成P2O5)
2P+3X2
P4O10 (常写成P2O5)
2P+3X2 2PX3 (X表示F2、Cl2、Br2) PX3+X2△PX5
P4+20HNO3(浓)=4H3PO4+20NO2↑+4H2O 3P4+20HNO3(稀) +8H2O =12H3PO4+20NO↑
2C+O2(少量)=2CO C+O2(足量)=CO2
C+CO2
2PX3 (X表示F2、Cl2、Br2) PX3+X2△PX5
P4+20HNO3(浓)=4H3PO4+20NO2↑+4H2O 3P4+20HNO3(稀) +8H2O =12H3PO4+20NO↑
2C+O2(少量)=2CO C+O2(足量)=CO2
C+CO2 2CO C+H2O
2CO C+H2O CO+H2(生成水煤气)
2C+SiO2
CO+H2(生成水煤气)
2C+SiO2 Si+2CO↑(制得粗硅) Si(粗)+2Cl2
Si+2CO↑(制得粗硅) Si(粗)+2Cl2 SiCl4
(SiCl4+2H2
SiCl4
(SiCl4+2H2 Si(纯)+4HCl) Si(粉)+O2
Si(纯)+4HCl) Si(粉)+O2  SiO2
Si+C
SiO2
Si+C SiC(金刚砂) Si+2NaOH+H2O=Na2SiO3+2H2↑
SiC(金刚砂) Si+2NaOH+H2O=Na2SiO3+2H2↑
(3)(碱中)歧化反应 Cl2+H2O=HCl+HClO (加酸抑制歧化、加碱或光照促进歧化) Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热、浓)△5KCl+KClO3+3H2O 3S+6NaOH=2Na2S+Na2SO3+3H2O 4P+3KOH(浓)+3H2O=PH3↑+3KH2PO2
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
3C+CaO CaC2+CO↑ 3C+SiO2
CaC2+CO↑ 3C+SiO2 SiC+2CO↑
SiC+2CO↑
25. NO+O2/NO2+O2与水充分反应的总反应方程式
4NO+3O2+2H2O = 4HNO3
4NO2+O2+2H2O = 4HNO3
24.Mg2N3/Al2S3的水解
Mg2N3+6H2O = 2Mg(OH)2↓+3NH3↑
Al2S3+6H2O = 2Al(OH)3↓+3H2S↑
23. 用硫粉除去洒落的Hg珠
S+2Hg==HgS 2Ag+S = Ag2S(两个反应均不须加热)
22.金属钠长期暴露在空气中的变化过程
(1)Na+O2==Na2O (2)Na2O+H2O==2NaOH
(3)2NaOH+CO2==Na2CO3+H2O (4)Na2CO3+CO2+H2O==2NaHCO3
(5)2NaHCO3△Na2CO3+CO2+H2O(风化) (6)Na2CO3+xH2O==Na2CO3·xH2O
21.硫粉与NaOH溶液共热
3S+6NaOH 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O
20.乙醇与活泼金属(Na/Mg等)反应
2CH3CH2OH+2Na==2CH3CH2ONa+H2↑(置换反应)
2CH3CH2OH+Mg==Mg(CH3CH2O)2+H2↑(置换反应)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com