
8.关于速度和加速度的关系,下列说法正确的有 ( )
A.加速度越大,速度越大
B.速度变化量越大,加速度也越大
C.物体的速度变化越快,则加速度越大
D.速度变化率越大则加速度越大
7.甲、乙两车沿平直公路通过同样的位移,甲车在前半段位移上以v1=40km/h的速度运动,后半段位移上以v2=60km/h的速度运动;乙车在前半段时间内以v1=40km/h的速度运动,后半段时间以v2=60km/h的速度运动,则甲、乙两车在整个位移中的平均速度大小的关系是( )
A.v甲=v乙 B.v甲>v乙 C.v甲<v乙 D.因不知为是和时间无法确定
6.对于做匀速直线运动的物体,则( )
A.任意2s内的位移一定等于1s内位移的2倍
B.任意一段时间内的位移大小一定等于它的路程
C.若两物体的速度相同,则它们的速率必然相同,在相同时间内通过的路程相等
D.若两物体的速率相同,则它们的速度必然相同,在相同时间内的位移相等
5.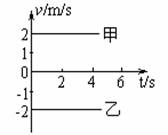 如图所示为甲、乙两质点的v-t图象。对于甲、乙两质点的运动,下列说法中正确的是( )
如图所示为甲、乙两质点的v-t图象。对于甲、乙两质点的运动,下列说法中正确的是( )
A.质点甲向所选定的正方向运动,质点乙与甲的运动方向相反
B.质点甲、乙的速度相同
C.在相同的时间内,质点甲、乙的位移相同
D.不管质点甲、乙是否从同一地点开始运动,它们之间的距
离一定越来越大
4.下列关于路程和位移的说法正确的是( )
A.路程是标量,位移是矢量。
B.给定初末位置,路程有无数种可能,位移只有两种可能。
C.若物体作单一方向的直线运动,位移的大小就等于路程。
D.路程是物体运动径迹的长度,位移描述了物体位置移动的方向和距离。
3.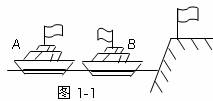 如图1-1所示,由于风的缘故,河岸上的旗帜向右飘,在河面上的两条船上的旗帜分别向右和向左飘,两条船运动状态是
( )
如图1-1所示,由于风的缘故,河岸上的旗帜向右飘,在河面上的两条船上的旗帜分别向右和向左飘,两条船运动状态是
( )
A.A船肯定是向左运动的
B.A船肯定是静止的
C.B船肯定是向右运动的
D.B船可能是静止的
2.在下列物体的运动中,可视作质点的物体有 ( )
A. 从北京开往广州的一列火车 B. 研究转动的汽车轮胎
C. 研究绕地球运动时的航天飞机 D. 表演精彩芭蕾舞的演员
1.下列关于质点的说法中,正确的是 ( )
A.质点是一个理想化模型,实际上并不存在,所以,引入这个概念没有多大意义。
B. 体积很小、质量很小的物体都可看成质点。
C. 不论物体的质量多大,只要物体的形状和大小对所研究的问题没有影响或影响 可以不略不计,就可以看成质点。
D. 只有低速运动的物体才可看成质点,高速运动的物体不可看作质点。
20.(2010·上海静安区模拟)可以通过实验探究有关物质氧化性和还原性的强弱。
Ⅰ.探究有关物质氧化性的强弱。
已知Bi位于周期表中VA族,+3价较稳定,NaBiO3溶液为无色,Bi3+无色;Mn2+无色,MnO4-呈紫红色;Pb位于周期表中IVA族,+2价较稳定,PbSO4是一种白色沉淀。取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体。
请回答下列问题:
(1)推测实验④中的现象为____________________________。
(2)分析上述现象,KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________。
Ⅱ.探究镁、铝、铜金属单质还原性的强弱。
现有镁条、铝片、铝粉、铜片、氧化镁、氧化铝、氧化铁、盐酸、硝酸银溶液、硫酸铜溶液及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证镁、铝、铜金属单质的还原性强弱。
依据你设计的实验方案,回答下列问题:
(3)实验原理:用化学方程式表示实验中的反应:
①________________________________________;
②________________________________________;
③________________________________________。
(4)实验现象:能够充分说明镁、铝、铜金属单质还原性强弱的明显现象是________。
[解析]Ⅰ.①向Mn(NO3)2溶液中滴加NaBiO3溶液时,溶液变为紫红色,说明有MnO4-生成,即Mn2+被氧化成MnO4-,NaBiO3溶液被还原成Bi3+,所以氧化性NaBiO3>KMnO4;②向所得到的KMnO4溶液中滴加H2O2,紫红色褪去,说明MnO4-被还原成Mn2+,H2O2被氧化成O2,所以氧化性KMnO4>H2O2;③向含Mn2+的溶液中加入PbO2固体,固体溶解,溶液又变为紫红色,说明Mn2+又被氧化成MnO4-,PbO2被还原成Pb2+,所以氧化性PbO2>KMnO4;④MnO4-可以将SO2氧化成SO42-,SO42-和Pb2+结合生成白色的PbSO4沉淀。
Ⅱ.镁、铝是活泼金属,能够和盐酸反应放出氢气,但是更活泼的镁反应更为剧烈;铜是不活泼金属,不能和盐酸反应放出氢气,但是可以和硝酸银溶液发生置换反应生成更不活泼的单质银。
[答案]
(1)紫红色褪去,生成白色沉淀
(2)PbO2>KMnO4>H2O2
(3)Mg+2HCl=MgCl2+H2↑ 2 Al+6HCl=2AlCl3+3H2↑
Cu+2AgNO3=Cu(NO3)2+2Ag
(4)镁条、铝片分别与盐酸反应时,镁条与盐酸反应更剧烈;铜和硝酸银溶液反应时,铜片表面有银白色物质析出版权所有:()
19.(2010·上海浦东区模拟)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是____________,化合价没有发生变化的反应物是________________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):
________________________________________________________________。
(3)上述反应中,1mol氧化剂在反应中_______(填“得到”或“失去”)____mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_________________________________________。
[解析]根据题给信息KMnO4和盐酸反应生成氯气,而所给物质中KCl中含有Cl-,H2SO4中含有H+,所以反应物是KMnO4、KCl和H2SO4,生成物是K2SO4、MnSO4、Cl2和H2O。锰元素化合价由+7价变成+2价,化合价降低,被还原;氯元素的化合价由-1价变成0价,化合价升高,被氧化,根据化合价升降数相等可得如下配平的化学方程式:2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O。在反应后的溶液中加入NaBiO3,溶液又变紫红色,说明有MnO4-生成,即BiO3-将Mn2+氧化成MnO4-,所以NaBiO3具有强氧化性,其氧化性比KMnO4氧化性强。
[答案](1)KCl;H2SO4
(2)2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O
(3)得到;5
(4)NaBiO3具有强氧化性(比KMnO4氧化性强)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com