
3.下列物质固态时一定是分子晶体的是 ( )
A.酸性氧化物 B.碱性氧化物
C.含氧酸 D.非金属单质
2.下列化合物中含有手性碳原子的是 ( )
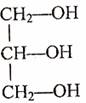
A.CCl2F2 B.
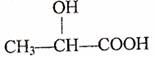
C.CH3CH2OH D.
1.下列叙述错误的是 ( )
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
 D.6Li和7Li的电子数相等,中子数也相等
D.6Li和7Li的电子数相等,中子数也相等
42.(太原成成中学九年级第五次月考)在家庭生活中,自来水经过处理后,用途更加广泛。
(1)净水器可以净化自来水,获得更优质的饮用水。①净水器中装有活性炭,其作用是________________;②净水器接通电源时产生紫外线与自来水生产中加氯气的目的相同,其作用是________________。
(2)用自来水养金鱼时为除去其中少量的余氯,可放入少许大苏打(化学式为Na2S2O3·5H2O)。大苏打由___________种元素组成,其中硫元素的化合价为__________。
 (3)水溶液在生产,生活中有着广泛的应用。冬天在汽车的水箱中加入少量乙二醇,可使水溶液的凝固点_____________,以防止水结冰。
(3)水溶液在生产,生活中有着广泛的应用。冬天在汽车的水箱中加入少量乙二醇,可使水溶液的凝固点_____________,以防止水结冰。
41.(2009年江苏省中考化学调研卷一)
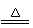
某集团是一家以生产电缆类产品为主的国家大型企业。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。
甲同学根据已学知识,提出了一套回收方案:

 乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4
+ O2
2CuSO4 + 2H2O),于是他提出了另一套方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4
+ O2
2CuSO4 + 2H2O),于是他提出了另一套方案:

(1)甲方案的①②③三个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
① ;② ;
③ 。
(2)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)的方案更合理。理由是: 。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。(2分)
丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该怎么处理呢?”。请提出你的想法: 。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。请写出使“绿矾”结晶的两种可能方法: 、 (“绿矾”溶解度随温度升高而增大)。如果直接排放掉滤液,不仅造成了浪费,还会 。
(5)若上述方案所用的稀硫酸溶质质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g,需水 mL(水的密度为1.0g/mL)。在实验室中稀释浓硫酸时,是如何操作的: 。(2分)
 (6)根据乙同学查出的方程式(2Cu + 2H2SO4
+ O2
2CuSO4 + 2H2O)计算:如果1000mL98%的浓硫酸(密度为1.84g/mL)稀释后全部参加了反应(假设硫酸不和碎电缆皮、其他杂质反应),所能处理的废料中含纯铜多少克?(请写出计算过程,结果精确到0.1克。5分)
(6)根据乙同学查出的方程式(2Cu + 2H2SO4
+ O2
2CuSO4 + 2H2O)计算:如果1000mL98%的浓硫酸(密度为1.84g/mL)稀释后全部参加了反应(假设硫酸不和碎电缆皮、其他杂质反应),所能处理的废料中含纯铜多少克?(请写出计算过程,结果精确到0.1克。5分)
40.(3分)某农场附近新建了一座燃煤火力发电厂后该农场的小麦产量急剧下降。经农场技术员测定:雨水pH约为4、土壤pH约为5。已知一些重要作物最适宜生长的土壤的pH如下表:
|
作物 |
①水稻 |
②小麦 |
③玉米 |
④油菜 |
⑤马铃薯 |
|
pH |
6-7 |
6.3-7.5 |
6-7 |
6-7 |
4.8-5.5 |
⑴根据上表数据,你认为这种土壤最适合种植的作物是(填编号) 。
⑵若继续种小麦,你认为最好选用以下(填编号) 试剂来改良土壤。
①工业盐酸 ②熟石灰 ③纯碱
⑶该地区形成酸雨的主要原因是 。
39.(常州市礼河实验学校调研测试试卷)(4分)“民以食为天”,人类生命活动所需的各种营养素主要来自于食物。
(1)右表是小明制定的食谱单,在食谱中含有营养素主要有 、 等;你认为小明制定的食谱中还较缺乏的一种营养素,请你在右表中填写获取该营养素的一种食物名称。
(2)为了增加营养在食品中添加一种或几种营养素,可以预防一些群体性疾病的发生。如铁强化酱油的推广使儿童 发病率明显下降。
38.(安丘市2009年中考模拟化学试题)(13分)镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国际上的主要趋势,工业流程图如下:
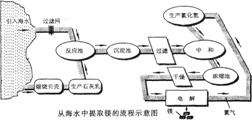
其步骤为:
I.将海边大量存在的贝壳(主要成分为CaCO3煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O
Ⅳ.将MgCl2·6H2O在一定条件下加热得到无水MgCl2
V.电解熔融的无水MgCl2可得到Mg(1)请根据上述步骤回答问题:
①写出步骤I、Ⅲ的有关化学方程式:
I.贝壳煅烧成生石灰 ;
Ⅲ.Mg(OH)2沉淀中加入盐酸中和 。
②步骤I-V中有分解反应的是(填写步骤序号): 。
③步骤11中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发需要的主要仪器有 、 、酒精灯、带铁圈的铁架台、坩埚钳等。
④上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?
请写出其中一点: 。
 (2)回答下列问题:
(2)回答下列问题:
①右图为镁元素的某种粒子结构示意图,该图表示(填序号)
A.分子 B.原子 C.阳离子D.阴离子.
 ②镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或”不活泼”)
金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应。
②镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或”不活泼”)
金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应。
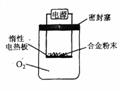
(3)为测定约含镁30%的镁铝合金(不含其它元素)中镁的质量分数。
①第一小组设计下列实验方案:称量a g镁铝合金粉末,放在如右
图所示装置的惰性电热板上,通电使其充分灼烧。
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是 。
讨论二:若用空气代替O2进行实验,对测定结果(填“有”或“无”) 影响。
②第二小组设计下列实验方案:称取b g镁铝合金,与足量的稀盐酸完全反应。
欲计算镁的质量分数,该实验中还需测定的一种数据是 。
|
主食 |
米饭、馒头 |
|
副食 |
烧鸡块、咸鸭蛋、红烧肉、 花生米 |
|
饮料 |
牛奶 |
|
你的补充 |
|
37.(安丘市2009年中考模拟化学试题)(11分)“从生活走进化学,从化学走向社会”。请你用化学知识回答以下生活中的问题:
(1)2008年9月的“三鹿奶粉”事件,震惊国人,掺有“蛋白精(三聚氰胺)”的毒奶粉使约29.4万名婴幼儿出现肾结石症状,奶农及全国的乳品企业遭受了巨大的经济损失。三聚氰胺的化学式为C3N3(NH2)3,三聚氰胺是一种 (填“有机”或“无机”)物,它含有 种元素,它的一个分子中含有_________个原子;含氮元素的质量分数为 (结果保留到0.1%)。
(2)人被蚊虫叮咬后皮肤会红肿痛痒,这是由于蚊虫在被叮咬的皮肤内注人了少量的酸性物质所致。在被咬的皮肤上涂少许下列生活用品中的 或 (填序号),痛痒便会消失。
A.香油 B.肥皂水 C.纯碱水 D.糖水
(3)2007年6月5日,在“南海一号”打捞出的文物中,“鎏金龙纹金手镯”光彩夺目、完好无损;铜镜表面有铜锈;铁器则锈迹斑斑或荡然无存。这说明金、铜、铁这三种金属的活动性从强到弱的顺序是 。
(4)做馒头发酵面团时,会产生乳酸等有机酸,揉面团时需加入适量的纯碱或小苏打,让它们相互作用产生 气体,使蒸出的馒头疏松多孔;若加入的纯碱或小苏打过多,可向面团或蒸锅中滴加少许酸性物质,如 ,否则蒸出的馒头会变涩,颜色发黄。
(5)工厂常用稀盐酸清洗铁制品表面的铁锈。该过程的化学方程式为: 。
36. (2009年淄博怡中外语学校迎中考试题一)
(1分)发现火险时,请不要惊慌,要沉着应付。
(1)火如果很小,根据起火的原因,可以自己用适当的方法把它扑灭。若发生下列情况时,你采用最简单的灭火方法是什么?炒菜锅中食油起火 ;
(2)火大,有蔓延的可能就应立即拨打火警电话 求救。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com