
31.答案:(1)1s22s22p6 (2)NaOH>Mg(OH)2
(3)NH3+H2O NH3·H2O
NH3·H2O NH
NH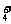 +OH-
+OH-
(4)分子晶体 (5)OH- H3O+
●命题趋向与应试策略
30.答案:(1)Ge Bi (2)Bi4Ge?SO12或Bi4(GeO4)3 (3)Bi2O3
解析:Ge与Si同族,锗酸类似于原硅酸,其酸根的形式应为GeO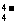 ,N与Bi同主族,最外层有5个电子,形成三对共用电子对即达8电子结构,故在BGO中呈+3价。所以BGO的化学式为Bi4(GeO4)3,铋的氧化物分子式为Bi2O3。
,N与Bi同主族,最外层有5个电子,形成三对共用电子对即达8电子结构,故在BGO中呈+3价。所以BGO的化学式为Bi4(GeO4)3,铋的氧化物分子式为Bi2O3。
29.答案:(1)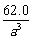 g·cm-3
(2)6∶91
g·cm-3
(2)6∶91

(2)设1 mol Ni0.97 O中含Ni3+x mol,Ni2+(0.97-x) mol
根据电中性:3x mol+2(0.97-x) mol=2×1 mol
x=0.06
Ni2+为(0.97-x) mol=0.91 mol
离子数之比:Ni3+∶Ni2+=0.06∶0.91=6∶91
28.答案:(1)A:NH3 B:HCN C:CO(NH2)2 D:BF3
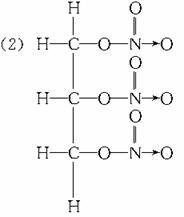
解析:首先注意题给限制条件1-10号元素,然后分析A结构中,最外层有两个未成键电子,且形成三个共价键,那么它最外层必然有5个电子,为N元素,另外三个为氢元素,则A的化学式为NH3,同理可分析出B、C、D的化学式分别为HCN、COHNH2)2和BF3,对三硝酸甘油酯的结构式可借助硝基甲烷中硝基结构写出。
27.答案:B
解析:CO2为分子晶体,其分子间作用力很弱,具有较低熔点;KCl为离子晶体,其离子间存在较强的离子键,有较高熔点;SiO2为原子晶体,原子间用较强的共价键相结合,因而熔点很高,所以CO2、KCl、SiO2熔点符合题意。
26.答案:B
解析:若从整个分子看,分子里电荷分布是对称的,则这样的分子为非极性分子。若整个分子的电荷分布不对称,则这样的分子为极性分子。所以分子的极性与构成的化学键及分子空间构型都有关系,如上述NH3中N-H为极性键,而分子构型为三角锥型, 为不对称排列;H2O中H-O也为极性键,分子构型为
为不对称排列;H2O中H-O也为极性键,分子构型为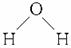 为不对称排列,所以它们都是由极性键构成的极性分子。
为不对称排列,所以它们都是由极性键构成的极性分子。
25.答案:C

24.答案:A
解析:SO2不可燃,如果继续氧化必须在加热时使用催化剂方可。
23.答案:①B ②B ③C
解析:①由元素周期律:同周期元素从左至右原子半径逐渐减小而至稀有气体元素突然变大。故选B。
②由卤素单质的性质递变:卤族元素单质从上到下沸点升高,可知应选B;或由晶体结构知识:F2、Br2属分子晶体,相对分子质量大者分子间作用力大,沸点高;或由二者常温状态判断:F2为气态而Br2为液态,即Br2沸点高。
③由同位素的定义:同位素原子间质子数相同(对原子来说即电子数相同)而中子数不同,故可确定选项。
22.答案:D
解析:HCl气体溶于水,在水分子作用下,电离为H+和Cl-,原HCl分子中共价键破坏。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com