
5.溶解度曲线: 。
(1)溶解度曲线上的点表示物质 ,溶液所处的状态 。
(2)溶解度曲线下面的的点,表示溶液所处的状态是 状态。
(3)溶解度曲线上面的点,依其数据配制的溶液为对应温度时的 溶液,且该溶质有剩余。
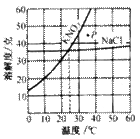 (4)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的 相等。
(4)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的 相等。
如:右图为硝酸钾和氯化钠的溶解度曲线。由图可知:
①当温度______时,硝酸钾与氯化钠的溶解度相等。
②当温度______时,氯化钠的溶解度大于硝酸钾的溶解度。
③图中P点表示KNO3对应的溶液是______
④当温度为10℃时,硝酸钾的溶解度是______ 。
4.固体溶解度:一定温度下,某物质在100g 里形成 时所溶解溶质的 。溶解度通常用S表示,单位为 。其数学表达式: 。
一般用固体物质在25℃时的溶解度大小来衡量其溶解性:
易溶 ,可溶 ,微溶 ,不溶 。
3.溶质的质量分数:用 溶液中所含溶质的 表示的浓度。
溶质的质量分数通常用ω表示,其数学表达式为 : 。
配制一定溶质的质量分数的溶液的操作步骤为① ② ③ 。现欲配制100g质量分数为10%的的NaOH溶液,需用到的实验仪器有 、
、 、 (必要时需注明仪器规格)。
2.饱和溶液:一定 下,一定量溶剂中不能 的溶液。溶液是否饱和是相对的,改变 、 、 等因素,不饱和溶液与饱和溶液可以相互转变。
1.溶液:一种或几种物质 到另一种物质里,形成 、 的混合物。
溶液由 、 组成。
3.对于化学平衡的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒沙特列原理挂钩。
(2)紧扣可逆反应的特征,搞清正反应方向是吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平。例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
 试题枚举
试题枚举
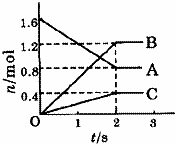
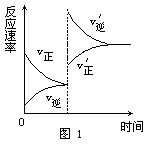
[例1]某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
解析:这类题目是讨论同一时间段内各物质的变化量的比例关系,且要注意物质的量减少的为反应物,物质的量增多的为生成物。又因物质的量都不变时,反应物、生成物共存,故方程式要用“ ”表示。
”表示。
答案:2A 3B+C;0.08mol/(L·s);0.12mol/(L·s)。
3B+C;0.08mol/(L·s);0.12mol/(L·s)。
[例2] 对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
 A.Z、W均为气体,X、Y中有一种是气体
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
解析: 经常有一些同学错选B,认为增大压强,平衡向气体体积缩小的方向移动.其实,图象告诉我们的是:增大压强,加快了正、逆反应,但逆反应速率增大的幅度大于正反应速率增大的幅度,由此而导致平衡向左移动.而压强的改变,只影响气体反应的速率,选项B所言的X、Y皆非气体即其正反应速率不受影响,故正确答案为A.
答案:A
[例3]下列各图是温度(或压强)对应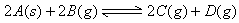 ;
; 的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
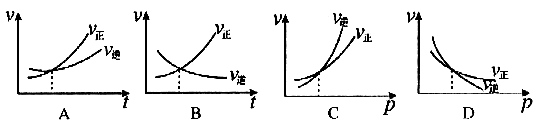
解析:曲线交点表示建立平衡时的温度或压强,升高温度,增加压强,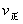 、
、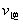 均增大,B中
均增大,B中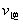 ,D中
,D中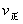 、
、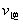 走向均减小,则B、D均错;可逆反应
走向均减小,则B、D均错;可逆反应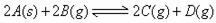 ;
;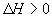 的正反应是一个气体体积增大的吸热反应,则升高温度,向正反应方向移动,故
的正反应是一个气体体积增大的吸热反应,则升高温度,向正反应方向移动,故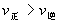 ;增加压强,向逆反应方向移动,故
;增加压强,向逆反应方向移动,故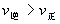 。
。
答案:A、C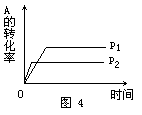
[例4] 现有可逆反应A(g)+2B(g) nC(g)+Q,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是 [ ].
nC(g)+Q,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是 [ ].
A.p1>p2,n>3 B.p1<p2,n>3
C.p1<p2,n<3 D.p1>p2,n=3
解析: 当其他条件不变时,对于有气体参加的可逆反应,压强越大,到达平衡的时间越短.图象中曲线和横轴平行,表明反应已达平衡.由图象知道,当压强为p2时,该反应到达平衡的时间较短,故p1<p2.在其他条件不变的情况下,增大压强会使化学平衡向着气体体积缩小的方向移动.因p1<p2,且当压强为p1时,A的转化率较大,所以正反应为气体体积增加的反应,即1+2<n,故正确答案选B。
答案:B
2.对于化学反应速率的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与有关的原理挂钩。
(2)看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物一般生成物多数以原点为起点。
(3)抓住变化趋势,分清正、逆反应,吸、放热反应。升高温度时,v(吸)>v(放),在速率-时间图上,要注意看清曲线是连续的还是跳跃的,分清渐变和突变,大变和小变。例如,升高温度,v(吸)大增,v(放)小增,增大反应物浓度,v(正)突变,v(逆)渐变。
(4)注意终点。例如在浓度-时间图上,一定要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
1.牢固掌握有关的概念与原理,尤其要注意外界条件的改变对一个可逆反应来讲,正逆反应速率如何变化,化学平衡如何移动,在速度-时间图、转化率-时间图、反应物的含量-浓度图等上如何体现。要能够画出有关的变化图象。
2.能够通过对图形、图表的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆
知识梳理
|
|
外因的变化 |
备注 |
对反应速率的影响 |
对化学平衡 的影响 |
|
浓度 |
增大反应物的浓度 |
固体物质除外 |
v正、v逆均增大,且v正>v逆 |
向正反应方向移动 |
|
减小生成物的浓度 |
v正、v逆均减小,且v正>v逆 |
|||
|
减小反应物的浓度 |
v正、v逆均减小,且v正<v逆 |
向逆反应方向移动 |
||
|
增大生成物的浓度 |
v正、v逆均增大,且v正<v逆 |
向逆反应方向移动 |
||
|
压强 |
增压引起浓度改变 |
固体和液体、恒容时充入不反应气体情况除外 |
v正、v逆均增大,只是增大的倍数不同 |
向气体体积减小的方向移动 |
|
减压引起浓度改变 |
v正、v逆均减小,只是减小的倍数不同 |
向气体体积增大的方向移动 |
试题枚举
[例1] 下列哪种说法可以证明反应N2 + 3H2  2NH3已达到平衡状态( )
2NH3已达到平衡状态( )
A. 1个N≡ N 键断裂的同时,有3个H - N键形成。
B. 1个N≡ N断裂的同时,有3个H - N键断裂。
C. 1个N≡ N断裂的同时,有6个H - N键断裂。
D. 1个N≡ N键断裂的同时,有6个H - N键形成。
解析:根据化学平衡的定义,当一个可逆反应达到平衡时V正= V逆 ,同时各物质的百分含量保持不变,从本质上来讲反应虽然仍在进行,但各种物质的绝对量不再变化,我们就称为达到平衡状态,对此题关键要分清谁表示V正 谁表示V逆 ,例如,1个N≡N断裂,即表示要向右进行,生成NH3即为V正 ;而6个N-H键断裂表示向左进行,生成N2与H2,即V逆。6个N-H形成,相当于生成2molNH3,表示V正 。根据同一反应中,用不同的物质来表示某反应的速率,若正、逆反应速率之比等于方程式各物质的系数之比,反应亦达到平衡,所以答案为A、C。
答案:A、C
[例2] 能够充分说明在恒温恒容下的密闭容器中,反应2SO2+O2 2SO3已达平衡状态的标志是
2SO3已达平衡状态的标志是
A.容器中SO2、O2、SO3的物质的量之比为2:1:2
B.SO2 和SO3的物质的量浓度相等
C.反应容器内压强不随时间变化而变化
D.单位时间内生成2molSO3 时,即生成1molO2
解析:由于题目中没有给出各物质的起始量,也没有给出反应的具体条件,所以无法知道容器中SO2、O2、SO3的物质的量之比为2:1:2时,及SO2 和SO3的物质的量浓度相等时反应是否达到平衡,也就是说无法知道达到平衡后,SO2 和SO3 的物质的量浓度上否相等。所以A、B选项不能选为答案。由于此反应是气体非等体积反应,在恒温恒容下,压强不变,说明各物质的浓度不变,故C选项正确。由于单位时间内生成2molSO3 时,即消耗了1molO2 ,此时又生成1molO2 ,即意味着正反应速率等于逆反应速率,所以D选项也正确。
答案:C、D
[例3]可逆反应: 3A(g) 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小趋势, 则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小趋势, 则下列判断正确的是
A.B和C可能都是固体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.B和C可能都是气体
解析: 本题考查平衡移动知识,重在考查分析问题、解决问题的能力.根据题干条件可对各选项逐一分析。选项A中,如果B和C都是固体,则无论平衡怎样移动,反应混合物中的气体只有A一种,A的相对分子质量不随温度升高而改变,所以气体的平均相对分子质量不随温度升高而改变,因此选项A不符合题意.选项C中,当C为固体,B为气体时,该反应为反应前后气体分子数不变的反应.由于温度升高平衡向吸热反应方向移动。有更多的固体C生成,使反应混合物中气体的总质量相应减小,而气体分子数保持不变,所以气体平均相对分子质量也相应变小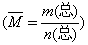 ,若C为固体,而B为非气体时,则反应混合物中的气体只有A,这与选项A情况相同,不符合题意要求,所以只有当C为固体时,B必为气体,才符合回意要求,选项C符合题意.既然选项C符合题意要求,则选项B一定不符合或意要求。选项D中,如果B和C都是气体,则正反应方向是气体分子数增大的方向,由于升温平衡向正反应方向移动,反应混合物中气体分子数相应增大,而反应混合物的总质量保持不变(反应物和生成物全部为气体)。所以气体平均相对分子质量变小.选项D符合题意.
,若C为固体,而B为非气体时,则反应混合物中的气体只有A,这与选项A情况相同,不符合题意要求,所以只有当C为固体时,B必为气体,才符合回意要求,选项C符合题意.既然选项C符合题意要求,则选项B一定不符合或意要求。选项D中,如果B和C都是气体,则正反应方向是气体分子数增大的方向,由于升温平衡向正反应方向移动,反应混合物中气体分子数相应增大,而反应混合物的总质量保持不变(反应物和生成物全部为气体)。所以气体平均相对分子质量变小.选项D符合题意.
答案:C、D。
[例4]密闭容器中一定量的混合气体发生反应: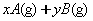

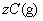 ,平衡时,测得A的浓度为0.50mol·L-1,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30mol·L-1,有关叙述不正确的是( )。
,平衡时,测得A的浓度为0.50mol·L-1,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30mol·L-1,有关叙述不正确的是( )。
A.平衡一定向右移动
B.B的转化率降低
C.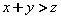
D.C的体积分数降低
解析:本题可采用虚拟的方法来解答。假设把容器扩大到原来的2倍时.平衡不移动(虚拟),则这时A的浓度由 0.50 mol·L-l变为0. 25 mol·L-l,而事实上A的浓度为 0.30 mol·L-1,然后再由虚拟状态回到事实.A的浓度由0.25 mol·L-1变为0.30 mol·L-1,平衡向生成A的方向即本反应逆反应方向移动。与备选选项对照,只有A项不正确。
答案:A
化学平衡的图像
考点聚焦
1.进一步掌握理解浓度、温度、压强、催化剂等条件对化学反应速率和化学平衡移动的影响。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com