
考点3.实验室制取气体的总结(学科内综合考点)
(1)实验室制取气体的一般思路:若要制取气体,首先研究生成该气体的化学反应原理,就是要研究在实验条件下(如常温、加热、加催化剂等),可用什么药品、通过什么反应来制取这种气体;第二,需要研究制取这种气体所采用的实验装置;第三,需要研究如何验证制得的气体就是所要制的气体。
(2)气体发生装置:①选择发生装置的原理:根据反应物的状态和反应条件。②常用发生装置:a.固体或固体混合物在加热条件下制取气体。此装置用于实验室制O2(氯酸钾和二氧化锰混合加热或高锰酸钾加热)。在信息给予题中可能出现用该装置制取NH3、CH4等气体。此装置也可用于Cu2(OH)2CO3的受热分解、木炭还原氧化铜等;b.固体与液体反应不需加热制取气体。此装置可用于实验室制取H2(用锌粒与稀盐酸或稀硫酸反应)、实验室制CO2(用大理石或石灰与石与稀盐酸反应),此装置还可能出现在信息给予题中用于制H2S等气体。
(3)气体收集方法:气体的收集方法取决于所制气体的溶解性和密度等,常见的方法有:①排水法:凡是不易溶于水(难溶、微溶)且不与水发生化学反应的气体都可用此法。操作时注意事项:a. 导气管刚过集气瓶口即可;b. 集气瓶中要预先装满水,用玻璃片盖住,倒置于水槽中,注意不要留气泡;c. 排水法收集时,实验刚开始有气泡冒出不宜立即收集,等气泡连续均匀出现后再收集。②排空气法可分为:a. 向上排空气法:气体密度大于空气的密度(相对分子质量>29),如:O2、CO2;b. 向下排空气法:气体密度小于空气的密度(相对分子质量<29),如:H2。操作时注意事项:a. 用排空气收集时,导管要伸入试管或集气瓶底部;b. 用向下排空气法收集满的集气瓶,要盖上玻璃片倒置于桌上。
考点4.温室效应(拓展考点)
随着工业生产的发展和人类生活水平的提高,煤、石油、天然气等矿物燃料的需求量不断增大,它们燃烧后放出大量二氧化碳气体。而由于一些天灾和人为的乱砍滥伐,能吸收二氧化碳的大片森林却在不断消失。因此,每年都有大量的二氧化碳进入大气,使大气中的二氧化碳的含量增大。在地球的大气层中,二氧化碳等气体能像温室的玻璃那样起保温作用。这就是所谓的“温室效应”。由温室效应引起的全球性气候变暖,将给人类带来严重后果。如严重的旱涝灾害,沙漠地区扩大,对农业、渔业、沿海生态系统、野生生物等都产生不良影响,人类应高度重视。为了保护我们人类赖以生存的地球,应该采取措施防止温室效应的进一步发展。可以采取的措施有:大量植树造林,禁止乱砍滥伐;减少使用煤、石油、天然气等化石燃料,更多地利用核能、太阳能、风能、地热等。
考点1.二氧化碳的性质和用途
|
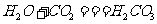 ,碳酸能使紫色石蕊试液变红。碳酸不稳定,受热易分解,
,碳酸能使紫色石蕊试液变红。碳酸不稳定,受热易分解,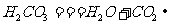 ③二氧化碳和澄清石灰水反应:二氧化碳和澄清石灰水中的氢氧化钙反应,生成不溶于水的白色物质碳酸钙,使澄清的石灰水变浑浊,
③二氧化碳和澄清石灰水反应:二氧化碳和澄清石灰水中的氢氧化钙反应,生成不溶于水的白色物质碳酸钙,使澄清的石灰水变浑浊,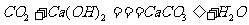 ,利用此反应可以鉴定CO2的存在。(3)二氧化碳的用途:①可用于灭火;②做制冷剂、人工降雨;③制汽水;④可用作温室肥料;⑤重要的化工原料,制纯碱、尿素等。
,利用此反应可以鉴定CO2的存在。(3)二氧化碳的用途:①可用于灭火;②做制冷剂、人工降雨;③制汽水;④可用作温室肥料;⑤重要的化工原料,制纯碱、尿素等。
考点2.二氧化碳的实验室制法
(1)药品:石灰石(或大理石)和稀盐酸。(2)反应原理:CaCO3+2HCl==CaCl2+CO2↑+H2O。(3)实验装置:类似于制氢气的装置,因为实验室制取CO2是常温下用固体和液体反应制得的。(4)收集方法:因为CO2能溶于水,不能用排水法收集;CO2的密度比空气大,可用向上排空气法收集。(5)检验方法:验证:把制得的气体通入澄清石灰水中,若澄清石灰水变浑浊,证明这种无色气体是CO2。验满:把燃着的木条放在集气瓶口,若火焰熄灭,证明瓶内已充满CO2。(6)注意:实验室制取CO2不能用碳酸钠代替大理石(或石灰石),原因是反应速率太快,不宜收集;不能用浓盐酸代替稀盐酸,原因是浓盐酸易挥发,使收集的CO2气体中混有较多氯化氢气体;也不能用稀硫酸代替稀盐酸,原因是生成的CaSO4微溶于水,覆盖在大理石(或石灰石)表面,阻止反应续续进行。
考点5.碳元素形成的其他单质(开放性考点)
近年来科学家们发现,除金刚石、石墨外,还有一些由碳元素形成的单质,如C60、纳米碳管等。一个C60分子是由60个碳原子构成的形似足球状的大分子,共有32个面的近似足球的结构中共有60个顶点,各有一碳原子。目前,人们对C60分子及纳米碳管的结构和反应的认识正在不断深入,它们在材料科学、超导体等方面的应用正在深入地研究。
第15讲 二氧化碳的性质、用途及制法
考点3.木炭和活性炭的吸附作用(拓展考点)
气体或溶液里的物质被吸附到固体表面的作用叫吸附作用,它属于物理变化。木炭和活性炭都有吸附性,因为它们都具有疏松多孔的结构而形成很大的表面积,表面积愈大,吸附能力愈强。活性炭是木炭经过水蒸气高温处理而得到的,它具有更大的表面积,因此,活性炭的吸附能力比木炭更强。
考点4.一氧化碳的检验方法(实际应用考点)
CO的检验方法有:(1)点燃待检气体,若火焰呈蓝色,则先用干燥小烧杯罩在火焰上方,无水珠,再用内壁涂有澄清石灰水的小烧杯罩在火焰上方,若出现白色浑浊物,则气体为CO;(2)将待检气体通过灼热的CuO,若出现红色的物质,且产生的气体不能使无水CuSO4变色而能使澄清石灰水变浑浊,则气体为CO。
考点1.碳的几种单质的性质和用途
(1)金刚石和石墨的物理性质和用途(见表6-14-1):
表6-14-1
|
物质 |
金刚石 |
石墨 |
|
|
物 理 性 质 |
色、态 |
无色透明正八面体形状的固体,琢磨后有夺目光泽 |
深灰色不透明细鳞片状的固体,有金属光泽 |
|
硬度 |
最硬的矿物之一(坚硬) |
最软的矿物之一(质软) |
|
|
熔点 |
高 |
高 |
|
|
导电性 |
不导电 |
良好 |
|
|
导热性 |
不导热 |
良好 |
|
|
用途 |
钻头、划玻璃、装饰品 |
电极、润滑剂、铅笔芯 |
(2)无定形碳:①构成:无定形碳都是由石黑的微小晶体和少量杂质构成的,无定形碳都是混合物。②分类:无定形碳包括木炭、活性炭、焦炭和炭黑四种。③用途:木炭和活性炭具有吸附作用,能把大量的气体或染料等微小粒子吸附在它的表面,活性炭的吸附作用比木炭强,防毒面具里的滤毒罐就是利用活性炭来吸附毒气的,制糖工业中利用活性炭来脱色以制白糖;焦炭常用于冶金工业,用于冶炼生铁;炭黑常用于制造墨、油墨、油漆、鞋油和颜料等。
(3)碳的化学性质:在常温下,碳的化学性质不活泼,表现出稳定性,随着温度升高,化学活动性大大增强,表现出可燃性和还原性。①可燃性:a. 碳与充足的氧气反应: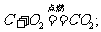
b. 碳不充分燃烧时: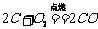 。②还原性: a. 碳还原氧化铜:
。②还原性: a. 碳还原氧化铜: 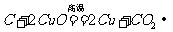 。现象:黑色粉末逐渐变成红色,产生的气体能使澄清的石灰水变浑浊;b.碳还原二氧化碳:
。现象:黑色粉末逐渐变成红色,产生的气体能使澄清的石灰水变浑浊;b.碳还原二氧化碳: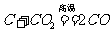 。
。
考点2.一氧化碳的性质和用途
(1)一氧化碳的物理性质:一氧化碳通常是无色、无味、有毒的气体,密度比空气略小,难溶于水。
|
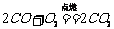 ;c. 注意:点燃一氧化碳前要验纯。②还原性;一氧化碳能将CuO(金属氧化物)还原成铜,同时生成二氧化碳:CO+CuO == Cu+CO2,因此一氧化碳可用于冶金工业。
;c. 注意:点燃一氧化碳前要验纯。②还原性;一氧化碳能将CuO(金属氧化物)还原成铜,同时生成二氧化碳:CO+CuO == Cu+CO2,因此一氧化碳可用于冶金工业。
(3)一氧化碳还原氧化铜的实验。操作顺序:与H2还原CuO的实验操作顺序一样,先通CO,再加热;实验完毕,先停止加热,继续通CO至试管冷却。尾气处理:因CO有剧毒,不能随意排入空气中,处理的基本原则是将CO燃烧掉,转化为无毒的CO2或收集备用。
(4)一氧化碳的毒性、产生方式及用途:①一氧化碳的毒性:CO和人体血红蛋白的结合力比氧与血红蛋白的结合力强,人吸入CO会造成人体缺氧,严重者会致死。②产生CO的三种主要方式:a. 氧气的量不足,碳燃烧不充分:③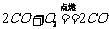 ;b. CO2遇到炽热的碳;
;b. CO2遇到炽热的碳;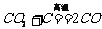 ;c. 碳与水蒸气高温条件下反应:
;c. 碳与水蒸气高温条件下反应: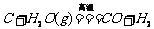 (水煤气)。③一氧化碳的用途:CO具有可燃性,可作燃料;CO具有还原性,可用来冶炼金属,如炼铁等。
(水煤气)。③一氧化碳的用途:CO具有可燃性,可作燃料;CO具有还原性,可用来冶炼金属,如炼铁等。
考点4.有关图像及数据分析题(探究性考点)
解有关图像、数据分析题时,都涉及化学反应,以化学方程式等化学知识作为分析推理的主要依据,分析图像及实验数据时要抓住“突破口”,以此为基础,逐层推导,分类讨论、判断、计算。
第六单元 碳和碳的氧化物
第14讲 碳及一氧化碳的性质、用途
考点3.有关天平平衡问题的计算(拓展考点)
有关天平平衡问题的计算一般是在平衡的天平两边的反应容器内加入不同的反应物,通过计算判断天平是否平衡。解答天平平衡问题可采用如下分析方法:设加到天平左、右两盘容器内的物质质量分别为m(左入)、m(右入);左、右两盘容器内放出的气体质量分别为m(左出)、m(右出);左、右两盘实际增重为△m(左)、△m(右),即△m(左)= m(左入)- m(左出);△m(右)= m(右入)- m(右出)。
则当△m(左)
正确找出或求出m(左入)、m(左出)、m(右入)、m(右出)是解此类题的关键。
考点1.有关纯净物的化学方程式的计算
有关纯净物的化学方程式的计算比较简单,但解题时要把握好三个要领,抓住三个关键,注意一个事项。三个要领:(1)步骤要完整;(2)格式要规范;(3)得数要准确。三个关键:(1)准确书写化学式;(2)化学方程式要配平;(3)准确计算相对分子质量。
考点2.反应物(或生成物)不纯的计算
化学方程式反映的是纯净物间的质量关系,因此,遇到不纯物时,要先把不纯的反应物(或生成物)的质量换算成纯净物的质量,再代入化学方程式进行计算。进行化学计算时,要注意“纯度”与“杂质质量分数”的区别。“纯度”是指在一定质量的不纯物质中纯净物质(主要成分)所占的质量分数,而“杂质质量分数”是指不纯物质中的杂质所占的质量分数。
 。
。
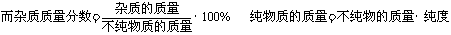 。
。
考点3.质量守恒定律的应用(实际应用考点)
(1)根据质量守恒定律,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。利用这一定律可以解释反应前后物质的质量变化及用质量差确定某反应物或生成物的质量。
(2)根据质量守恒定律,化学反应前后元素的种类和质量不变,由此可以推断反应物或生成物的组成元素。
考点4.质量守恒定律与化学方程式的综合应用(学科内综合考点)
(1)根据质量守恒定律:化学反应前后元素的种类和数目相等,推断反应物或生物的化学式。
(2)已知某反应物或生成物质量,根据化学方程式中各物质的质量比,可求出生成物或反应物的质量。
第13讲 根据化学方程式的计算
考点1.质量守恒定律
(1)质量守恒定律:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。①质量守恒定律适用的范围是化学变化而不是物理变化;②质量守恒定律揭示的是质量守恒而不是其他方面的守恒。物体体积不一定守恒;③质量守恒定律中“参加反应的”不是各物质质量的简单相加,而是指真正参与了反应的那一部分质量,反应物中可能有一部分没有参与反应;④质量守恒定律的推论:化学反应中,反应前各物质的总质量等于反应后各物质的总质量。
(2)质量守恒定律的微观解释:在化学反应过程中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化。所以化学反应前后各物质的质量总和必然相等。①化学变化中的“一定不变”:原子种类、原子数目、原子质量、元素种类、反应前后各物质的总质量一定不变;②化学变化中的“一定改变”;分子种类、物质种类一定改变;③化学变化中的“可能改变”:分子数目可能改变。
考点2.化学方程式
(1)定义:用化学式来表示化学反应的式子。(2)书写原则:①必须以客观事实为依据;②必须遵守质量守恒定律。(3)书写方法:①正确书写反应物和生成物的化学式;②配平化学方程式,然后将连线改为等号;③注明化学反应的条件及生成物的状态等。(4)配平化学方程式的方法:观察法、最小公倍数法、奇数配偶数法等。(5)化学方程式的读法:从左到右,先读反应物,后读生成物,反应物中“+”号读成“跟”、“与”或“和”。生成物中“+”读“和”。“==”读成“生成”。条件读“在……条件下反应”。(6)化学方程式表示的意义:①表示反应物、生成物以及反应条件;②表示反应物、生成物各物质之间的质量比;③表示反应物、生成物的各粒子的相对数量关系。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com