
9.下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是 ( )
A.氢氧化钠和硫酸铝 B.氢氧化钠和氯化镁
C.硫酸钠和氧氧化钡 D.氯化铝和氨水
8.下列离子方程式书写正确的是 ( )
A.NaHCO3溶液中加入少量NaHSO4溶液:HCO +HSO
+HSO =SO
=SO +H2O
+H2O
B.Ca(HCO3)2溶液中辊入少量Ca(OH)2溶液:Ca2++OH-+HCO =CaCO3↓+H2O
=CaCO3↓+H2O
C.金属铝溶于氧化钠溶液:2Al+6OH-=2AlO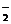 +3H2↑
+3H2↑
D.Fel2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3+=2Cl-
7.下列有关工业生产的叙述正确的是 ( )
A.合成氮生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精练铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
6.关于下列反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.产物中的SO 有一部分是氧化产物
有一部分是氧化产物
C.5 mol FeS2发生反应,有10 mol电子转移
D.FeS2只剩还原剂
5.菜温度下将氯气通入氢氧化钾溶液里,反应后得到KCI、KClO、KClO3的混合溶液。经测定ClO和ClO3的浓度之比为11:l,则氯气和氢氧化钾溶液反应时,被还原的氯元素和被氯化的氧元素的物质的量之比为 ( )
A.1:3 B.4:3 C.2:l D.3:l
4.氢氧化铁胶体稳定存在的主要原因是 ( )
A.胶粒直径小于1nm B.胶体有丁达尔现象
C.胶粒带正电荷 D.胶粒不能通过半透膜
3.有关晶体的叙述正确的是 ( )
A.在SiO2晶体中,由Si、O构成的最小单元环是8元环
B.在12g金刚石中,含C-C共价键键数为4NA个
C-在60g二氧化硅中,含Si2O共价键键数为4NA个
D.在NaCl晶体中,与Na+最近且距离相等的Na+有6个
2.根据下列实验事实,能确定某晶体一定是离子晶体的是 ( )
A.晶体熔点达2500℃ B.晶体不导电,溶于水导电
C.晶体不导电,熔融能导电 D.温度越高,溶解度越大
1.下列关予溶液和胶体的叙述,正确的是 ( )
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一级移动
C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体对,后者会出现明显的光带,前者则没有
2.电解精炼
电解时,以 作电解液, 作阴极, 作阳极
试题枚举
[例1] 在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2; ②Fe2O3; ③Na; ④Ca(NO3)2。铜粉可溶解的是( )
A.①② B.②④ C.②③ D.①④
解析: 加入Fe2O3反应生成Fe3+能氧化铜,加入Ca(NO3)2后等于铜和硝酸反应而消耗。
答案:B
[变式] 现有下列试剂:①食盐水 ②稀H2SO4 ③氯化铁 ④盐酸 ⑤NaOH溶液 ⑥硝酸银 ⑦硝酸钾,如将Cu转化为CuCl2,可采用的一组试剂是( )
A.④⑤⑥ B.③④⑤ C.①②③ D.④⑤⑦
[例2] 在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为:4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为:1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为( )
A.5:4 B.4:5 C.3:5 D.5:6
解析: 溶液中还存在Fe3+,说明溶液中Cu2+没有反应,加入的铁全部反应,将粒子比例调整为:12:6:3和2:6:18,若溶液中由6molCu2+,就有10molFe3+发生反应,消耗5mol铁。
答案: D
[变式]将Cu片放入0.l mol / L FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶3,则Cu2+与Fe3+的物质的量之比为
A.3∶2 B.3∶5 C.4∶3 D.3∶4
[例3] 如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:
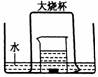 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;
(2)实验中观察到的主要现象是:
①_______________________________ ;
②_______________________________ ;
③_______________________________ ;
④_______________________________ 。
(3)用该装置做铜与浓硝酸反应实验的优点:______________ ;
(4)大烧杯内最终所得气体产物的化学式: ;若要验证此气体产物,最简便的方法:_________________________________________ 。
解析:分析实验现象要从导致产生实验现象的物质开始分析,如从小烧杯发生的反应到产生气体颜色的变化,再到烧杯内液面高度的改变,逐一分析,才能做到全面分析。
答案:(1)Cu+4HNO3 ==Cu(NO3 )2 +2NO↑+2H2O
(2)①铜片表面产生气泡; ②小烧杯中溶液逐渐变成蓝色;③大烧杯中有红棕色气体生成,气体颜色又逐渐褪去;④大烧杯内液面上升,水槽中液面下降。
(3)体系封闭,无氮氧化合物逸出,不污染环境。
(4)NO;轻轻掀起倒扣的大烧杯,放入适量空气,若有红棕色气体生成,最终气体为NO。
[例4] Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
解析:由题给信息可知,Cu2O是碱性氧化物,可溶于酸溶液:Cu2O+2H+=2Cu++H2O;而Cu+在酸溶液中不稳定,自身歧化成Cu2+和Cu。2Cu+=Cu2++Cu。题给试剂中,浓硫酸、浓硝酸、稀硝酸、FeCl3稀溶液均显酸性,且都能与Cu反应生成Cu2+,如果选用这些试剂,它们和样品反应后的溶液都呈蓝色(Cu2+),但分不清是与Cu还是与Cu2O反应产生的Cu2+,故无法确证样品中是否含有Cu2O。根据以上分析,选用的试剂必须符合两个条件,一是呈酸性,二是不能与Cu反应。在题给试剂中只有稀硫酸符合。
答案:取少量待检样品放入稀硫酸 ,振荡,若溶液变为蓝色,说明样品中有Cu2O,若溶液不变色,说明产物中无Cu2O。
[例5]孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成。
孔雀石__________________________;石青__________________________;
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比 。
解析: (1)设孔雀石的化学式为xCuCO3•yCu(OH)2
则依题意 = = 孔雀石的化学式为 CuCO3•Cu(OH)2
又设石青的化学式为 xCuCO3•yCu(OH)2
则依题意 = = 石青的化学式为 CuCO3•Cu(OH)2
(2)设该样品中孔雀石物质的量分数为x,则石青为 1- x
= =
=
孔雀石与石青物质的量之比为1:1。
答案:(1)CuCO3•Cu(OH)2;CuCO3•Cu(OH)2 (2) 1:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com