
26、(7分)Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,溶于足量水并充分反应后,溶液中Ca2+、CO32-、HCO3-全部转化为沉淀,将反应容器内水分蒸干,最后得到白色固体29.0g。则原混合物中Na2CO3的质量是多少?
25、(5分)已知Cu2O是一种红色固体物质,在酸性溶液中可发生反应生成Cu2+和Cu。请用已学过的知识设计一个最简便的实验方案,来检验CuO经氢气还原所得到的红色产物中是否有Cu2O。
实验步骤
实验现象与与结论
化学方程式
24、(6分)小明、小鹏和小芳三位同学在一起探究蜡烛燃烧,他们将短玻璃导管插入焰心,发现另一端也可以点燃。
⑴【提出问题】导管里一定有可燃性气体,气体成分可能会是什么呢?
⑵【猜 想】小明认为:可能是蜡烛不完全燃烧时产生的CO。
小鹏认为:可能是蜡烛受热后产生的蒸气。
小芳认为:可能上述两种情况都有。
⑶【设计实验方案】请你帮他们设计一个简单的实验方案,来判断哪一种分析是正确的。
。
⑷【现象与结论】如果小明的猜想正确,现象应是 。
如果小鹏的猜想正确,现象应是 。
如果小芳的猜想正确,现象应是 。
⑸如果用CnH2n+2表示蜡烛的主要成分,其燃烧的化学方程式为: 。
⑵若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL) mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为 。
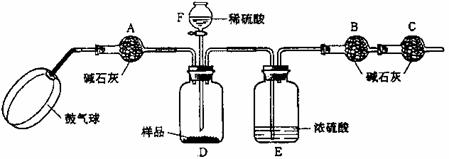
【实验步骤】
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
⑧按动鼓气球,持续约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用是 ,干燥管C的作用是 ,E装置的作用是 。步骤③中鼓气的目的是 ;步骤⑥中鼓气的目的是 ;本实验能否同时省略③、⑥两个步骤? ,原因是 。
23、(11分)某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,进行如下实验:
【实验原理】Na2CO3+H2SO4 = Na2SO4 + H2O + CO2↑
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
【实验装置】
22、(6分)为防止大气污染,工业上产生的硫化氢(H2S)要经过处理,使其变成硫单质。富玛克斯法治理硫化氢的方法和步骤如下:
①用2%~3%的Na2CO3溶液作吸收剂生成两种酸式盐,其中一种为NaHS;
②再加入一种RNO(液)(R表示一种有机基团)与生成的这种酸式盐的水溶液反应生成硫、碱和RNHOH;
③第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
④RNHOH与空气中的氧发生反应又得到RNO。
⑴写出上述四步反应的化学方程式。
① ;② ;
③ ;④ 。
⑵富玛克斯法的总反应的化学方程式为: ,RNO在整个过程中起到 的作用。
21、(5分)X和Z是由A、B、C三种元素(A、B、C均为1~18号元素)形成的两种化合物。已知元素A在两种化合物中的质量分数分别为29.1%和17.0%,且B、C的质量比在两种化合物中是相同的。已知化合物X的化学式为A2B2C3,Z的化学式为A2BxCy。X的溶液跟
盐酸混合时有气体和浅黄色沉淀生成,该气体是形成酸雨的主要原因。则元素A是 ,B是 ,C是 (填元素符号),Z的化学式为 。
20、(7分)某乡的村民普遍患有一奇怪的疾病,脱发、失明甚至死亡。经中国科学院地化所专家对该地区水源、植物进行分析,确定引起疾病的原因是附近矿山乱挖滥采,使水源中含铊(T1)元素过高所致。
⑴为使当地民众摆脱困境,当务之急应采取的措施是 。
⑵高纯铊及其合金可作半导体材料,价格与黄金相当。写出分三步使硫酸亚铊转化为纯铊的化学方程式。
、 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com