


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
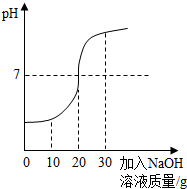 化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法,请回答有关问题:
化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法,请回答有关问题:查看答案和解析>>
科目:初中化学 来源: 题型:
 我县蕴含丰富的石灰石资源,小欣同学在山上采集了一块石灰石样品,想测定石灰石中碳酸钙的含量.小欣与同学们讨论后得出以下方案.
我县蕴含丰富的石灰石资源,小欣同学在山上采集了一块石灰石样品,想测定石灰石中碳酸钙的含量.小欣与同学们讨论后得出以下方案.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是盛装浓硝酸的试剂瓶上的标签,化学实验中用到的浓硝酸必须保存在棕色的细口瓶中,打开瓶塞时,会看到有白雾产生.浓硝酸在一定条件下会发生分解反应,生成一种有色的大气污染物,一种能供给呼吸的气体和另外一种最常见的溶剂.
如图是盛装浓硝酸的试剂瓶上的标签,化学实验中用到的浓硝酸必须保存在棕色的细口瓶中,打开瓶塞时,会看到有白雾产生.浓硝酸在一定条件下会发生分解反应,生成一种有色的大气污染物,一种能供给呼吸的气体和另外一种最常见的溶剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com