
| 实验一 | 实验二 | |
| 实验 过程 |  |  |
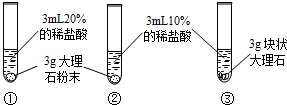
| 实验现象 | 大理石表面冒气泡,试管外壁微热.试管①、②、③中产生气泡快慢的顺序为:①>②>③. | 试管④中无明显现象,⑤中可观察到大量的气泡,两只试管上方的木条均未复燃. |
| 分析与 结论 | (1)大理石与稀盐酸反应的化学方程式为______; (2)对比实验①②可知,______,化学反应的速度越快;对比实验______(填实验序号)可知,反应物的接触面积越大,化学反应的速度越快. | (1)对比实验④⑤可知,影响化学反应速度的因素还有______; (2)试管⑤中产生了大量氧气,但是木条却未复燃,可能的一种原因是 ______. |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:初中化学 来源: 题型:
| 实验一 | 实验二 | |
| 实验 过程 |
 |
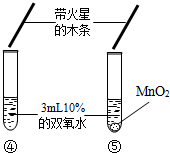 |
| 实验现象 | 大理石表面冒气泡,试管外壁微热.试管①、②、③中产生气泡快慢的顺序为:①>②>③. | 试管④中无明显现象,⑤中可观察到大量的气泡,两只试管上方的木条均未复燃. |
| 分析与 结论 |
(1)大理石与稀盐酸反应的化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ ;(2)对比实验①②可知, 反应物的浓度越大 反应物的浓度越大 ,化学反应的速度越快;对比实验②③ ②③ (填实验序号)可知,反应物的接触面积越大,化学反应的速度越快. |
(1)对比实验④⑤可知,影响化学反应速度的因素还有 催化剂 催化剂 ;(2)试管⑤中产生了大量氧气,但是木条却未复燃,可能的一种原因是 氧气中混有水蒸气 氧气中混有水蒸气 . |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验 序号 |
过氧化氢溶液浓度/% | 过氧化氢溶液体积/ml | 温度/℃ | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | --------------- | 2 | 49.21 |
| ④ | 30 | 5 | 55 | --------------- | 2 | 10.76 |
查看答案和解析>>
科目:初中化学 来源: 题型:
以下是某研究小组 探究影响化学反应速率部分因素的相关实验数据。
探究影响化学反应速率部分因素的相关实验数据。
| 实验 序号 | H2O2溶 液浓 度/% | H2O2溶液 体积/mL |
| MnO2的 用量/g | 收集氧 气的体 积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
(1)通过 实验①和②对比可知,化学反应速率与________有关;从实验__________和__________对比可知,化学反应速率与温度的关系是______________________。
实验①和②对比可知,化学反应速率与________有关;从实验__________和__________对比可知,化学反应速率与温度的关系是______________________。
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是____________________________。
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产 生氧气的总重量________(选填“减小”“不变”或“增大”)。
生氧气的总重量________(选填“减小”“不变”或“增大”)。
查看答案和解析>>
科目:初中化学 来源:2011-2012学年安徽省蚌埠市新城实验学校九年级(上)月考化学试卷(第一、二单元)(解析版) 题型:解答题
| 实验 序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液体积/ml | 温度/℃ | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | --------------- | 2 | 49.21 |
| ④ | 30 | 5 | 55 | --------------- | 2 | 10.76 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com