【答案】
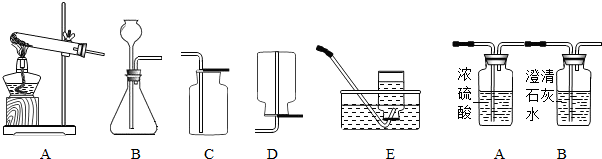
分析:(1)根据实验室用氯酸钾制取氧气的反应原理、药品的状态及反应条件、氧气的性质回答.
(2)根据氧气的性质回答,如溶解性、密度、是否与水反应等.
(3)根据氧气的助燃性和二氧化碳能使澄清的石灰水变浑的性质回答.
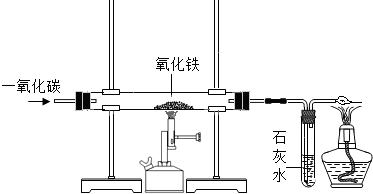
(4)根据炼铁的原理、实验现象和一氧化碳的性质判断.
解答:解:(1)实验室用氯酸钾制取氧气的反应是氯酸钾在加热和二氧化锰催化的条件下分解,生成氯化钾、氧气,方程式为:2KClO
3
2KCl+3O
2↑;是加热固体制气体,用装置A;因为氧气有助燃性,可用带火星的小木条验满,将一根带火星的木条放在集气瓶口,如观察到木条复燃,则证明氧气已经收满.
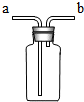
(2)氧气不易溶解于水,可用排水法收集,因为氧气的密度小于水的密度,所以水要从长管排出,则气体从b通入.
(3)因氧气有助燃性,将燃着的木炭伸入盛氧气的集气瓶中,木炭燃烧更旺发出白光;由于反应生成二氧化碳,且二氧化碳能使澄清的石灰水变浑,所以集气瓶中澄清石灰水会变浑浊;该反应是二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,方程式为:Ca(OH)
2+CO
2═CaCO
3↓+H
2O.
(4)炼铁的原理利用一氧化碳与氧化铁在高温下反应,生成铁和二氧化碳,方程式为:3CO+Fe
2O
3
2Fe+3CO
2;氧化铁是红色固体,铁粉是黑色固体,所以实验中玻璃管内的粉末由红色变黑色;通过该实验的全部装置中的实验现象,证明一氧化碳能还原氧化铁,具有还原性,尾气必须处理是因有毒性,用点燃的方法处理尾气,证明一氧化碳有可燃性.
故答案为:(1)2KClO
3
2KCl+3O
2↑; A; 将带火星的木条放在集气瓶口内沿处,若木条复燃,则氧气已经收集满了.(2)b(3)木炭燃烧发出白光,放热,澄清石灰水表面、液面上集气瓶内壁出现一层白膜; Ca(OH)
2+CO
2═CaCO
3↓+H
2O.(4)黑;3CO+Fe
2O
3
2Fe+3CO
2;可燃性,还原性,毒性.
点评:气体的制取是初中重要的化学实验之一,既是难重点,又是考查热点,理解反应原理,掌握装置的选择依据、气体的检验、验满、收集方法,了解实验步骤和注意事项是解决该类问题的关键.


 2KCl+3O2↑;是加热固体制气体,用装置A;因为氧气有助燃性,可用带火星的小木条验满,将一根带火星的木条放在集气瓶口,如观察到木条复燃,则证明氧气已经收满.
2KCl+3O2↑;是加热固体制气体,用装置A;因为氧气有助燃性,可用带火星的小木条验满,将一根带火星的木条放在集气瓶口,如观察到木条复燃,则证明氧气已经收满. 2Fe+3CO2;氧化铁是红色固体,铁粉是黑色固体,所以实验中玻璃管内的粉末由红色变黑色;通过该实验的全部装置中的实验现象,证明一氧化碳能还原氧化铁,具有还原性,尾气必须处理是因有毒性,用点燃的方法处理尾气,证明一氧化碳有可燃性.
2Fe+3CO2;氧化铁是红色固体,铁粉是黑色固体,所以实验中玻璃管内的粉末由红色变黑色;通过该实验的全部装置中的实验现象,证明一氧化碳能还原氧化铁,具有还原性,尾气必须处理是因有毒性,用点燃的方法处理尾气,证明一氧化碳有可燃性. 2KCl+3O2↑; A; 将带火星的木条放在集气瓶口内沿处,若木条复燃,则氧气已经收集满了.(2)b(3)木炭燃烧发出白光,放热,澄清石灰水表面、液面上集气瓶内壁出现一层白膜; Ca(OH)2+CO2═CaCO3↓+H2O.(4)黑;3CO+Fe2O3
2KCl+3O2↑; A; 将带火星的木条放在集气瓶口内沿处,若木条复燃,则氧气已经收集满了.(2)b(3)木炭燃烧发出白光,放热,澄清石灰水表面、液面上集气瓶内壁出现一层白膜; Ca(OH)2+CO2═CaCO3↓+H2O.(4)黑;3CO+Fe2O3 2Fe+3CO2;可燃性,还原性,毒性.
2Fe+3CO2;可燃性,还原性,毒性.




 生活中处处有化学.认识和探究身边的化学物质.是学习化学的重要内容:请用所学的化学知识填空.
生活中处处有化学.认识和探究身边的化学物质.是学习化学的重要内容:请用所学的化学知识填空.