
科目: 来源:不详 题型:问答题

查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:填空题
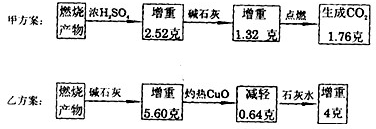
查看答案和解析>>
科目: 来源:不详 题型:填空题

| 实验前 | 实验后 | |
| (氧化铜+玻璃管)的质量/g | 75.6 | 69.2 |
| (氧化钙+U型管)的质量/g | 110.8 | 118.0 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
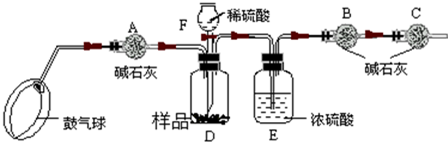
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:填空题

| 实验前 | 实验后 | |
| 铜的氧化物+玻璃管* | 137.8g | 131.4g |
| 氧化钙十U形管 | 100.8g | 108g |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 操作 | 现象 | 结论 |
| 取少量两种滤液分别于两支试管中,滴加少量______ | 优质珍珠粉的滤液没有变色;廉价“珍珠粉”的滤液变红 | 猜想①成立 |
| 取少量两种滤液分别于两支试管中,加入一定量______,加热至沸腾 | 优质珍珠粉的滤液有黄色出现,局部变黑;廉价“珍珠粉”的滤液没有明显现象 | 猜想②成立 |
| 优质珍珠粉 | 廉价“珍珠粉” | |
| 固体粉末的质量 | 10.00g | 10.00g |
| 加入稀盐酸的质量 | 46.00g | 50.13g |
| 反应后烧杯中物质的质量 | 52.00g | 55.77g |
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:问答题
| ||
| ||
| 实验步骤 | 实验现象 | 实验结论及分析 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液后加热,并将湿润的红色石蕊试纸放在试管口. | ______ | 滤液中含有NH4Cl,有关化学方程式: NaOH+NH4Cl=NaCl+NH3↑+H2O |
| ②另取少量滤液于试管中,滴加稀盐酸. | 产生无色 无味气体. | 滤液中含有______,有关化学方程式: ______. |
| ③另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,滴加稀HNO3,再滴加AgNO3溶液. | 产生白色沉淀. | 滤液中含有______,滤液蒸干后充分灼烧的目的是______. |
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀. | 反应的化学方程式: ______. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com