
科目: 来源: 题型:解答题
| 温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 溶解度(g/100g水) | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.0 | 60.2 |

查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品b于烧杯中,加足量蒸馏水,并用玻璃棒搅拌 | 样品溶解,形成无色溶液. |
| 步骤2:取少量步骤1形成的溶液于试管中,在滴加少量NaOH溶液,振荡 | 有白色沉淀生成,说明样品b中添加了镁盐 |
| 步骤3:取少量步骤1形成的溶液于试管中,再滴加少量的BaCl2溶液振荡 | 若有白色沉淀产生,则添加的是MgSO4.若无明显现象,则添加的是MgCl2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 配制并稀释一定质量分数的Na2SO4溶液.
配制并稀释一定质量分数的Na2SO4溶液.查看答案和解析>>
科目: 来源: 题型:解答题

| 选用药品 | 发生装置 | 收集装置 |
| H2O2溶液、MnO2 | B | D或F |
| KMnO4 | A |
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室有如图所示装置,回答下列问题:
实验室有如图所示装置,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 | 温度/℃ | 反应时间/h | 粗蹄沉淀率 |
| a | 65 | 3.0 | 65.0 |
| b | 80 | 3.0 | 98.9 |
| c | 80 | 2.0 | 98.9 |
| d | 90 | 2.0 | 97.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
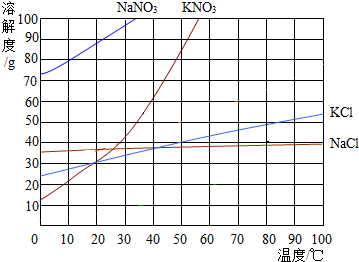 如图为几种固体的溶解度曲线,回答下列问题:
如图为几种固体的溶解度曲线,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 盐酸是一种重要的化工产品,也是实验室中重要的化学试剂.
盐酸是一种重要的化工产品,也是实验室中重要的化学试剂. H+,
H+, Cl-,
Cl-, Fe2+.
Fe2+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com