
科目: 来源: 题型:填空题
 如图是初中科学常见物质间的转化关系(部分反应物和生成物已略去,各步均恰好完全反应).已知:A是黑色固体粉末,C是一种蓝色溶液,G是不溶于稀硝酸的白色沉淀.试回答:
如图是初中科学常见物质间的转化关系(部分反应物和生成物已略去,各步均恰好完全反应).已知:A是黑色固体粉末,C是一种蓝色溶液,G是不溶于稀硝酸的白色沉淀.试回答:查看答案和解析>>
科目: 来源: 题型:选择题
 为验证混合气体中是否含有CO,CO2,H2O,H2 这四种气体,现有无水硫酸铜,澄清石灰水,浓硫酸,氢氧化钠溶液以及如图所示装置甲.能验证这四种气体的方法正确的是( )
为验证混合气体中是否含有CO,CO2,H2O,H2 这四种气体,现有无水硫酸铜,澄清石灰水,浓硫酸,氢氧化钠溶液以及如图所示装置甲.能验证这四种气体的方法正确的是( )| A. | 依次通入无水硫酸铜,澄清石灰水,浓硫酸,甲装置,无水硫酸铜,澄清石灰水 | |
| B. | 依次通入无水硫酸铜,澄清石灰水,甲装置,无水硫酸铜,澄清石灰水 | |
| C. | 依次通入澄清石灰水,无水硫酸铜,浓硫酸,甲装置,无水硫酸铜,澄清石灰水 | |
| D. | 依次通入无水硫酸铜,澄清石灰水,浓硫酸,甲装置,澄清石灰水,无水硫酸铜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑥ | C. | ①②④ | D. | ③⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知:MgSO4+2NaOH═Mg(OH)2+Na2SO4,Al2(SO4)3+6NaOH═2Al(OH)3+3Na2SO4,Al(OH)3+NaOH═NaAlO2+2H2O,Mg(OH)2不溶于NaOH溶液,现剪取wg镁铝合金的易拉罐壳,先用过量硫酸溶解,然后再向溶液中滴加NaOH溶液,反应符合下列图象关系(横坐标表示滴加NaOH溶液的质量,纵坐标表示生成沉淀质量),则下列说法不正确的是( )
已知:MgSO4+2NaOH═Mg(OH)2+Na2SO4,Al2(SO4)3+6NaOH═2Al(OH)3+3Na2SO4,Al(OH)3+NaOH═NaAlO2+2H2O,Mg(OH)2不溶于NaOH溶液,现剪取wg镁铝合金的易拉罐壳,先用过量硫酸溶解,然后再向溶液中滴加NaOH溶液,反应符合下列图象关系(横坐标表示滴加NaOH溶液的质量,纵坐标表示生成沉淀质量),则下列说法不正确的是( )| A. | a点表示NaOH溶液与剩余的硫酸恰好完成反应 | |
| B. | 在M点时,溶液中有两种溶质 | |
| C. | N点表示Al(OH)3沉淀刚好完成溶于NaOH溶液 | |
| D. | 生成氢氧化镁沉淀的质量为(m1-m2)g |
查看答案和解析>>
科目: 来源: 题型:解答题
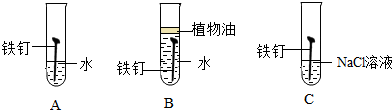
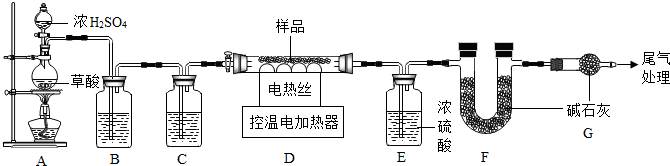
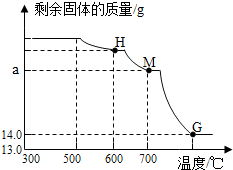
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com