
科目: 来源:南京市高淳县2017届九年级中考二模化学试卷 题型:探究题
镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】
常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】
常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】
通过控制与镁条接触的物质,利用下图装置(镁条长度为3cm,试管容积为20mL,试剂量合适),分别进行下列5个实验,并持续观察20天。

实验现象:实验1、2、3、4中镁条始终无明显变化,实验5中镁条第3天开始变黑,至第20天全部变黑
【解释与结论】
(1)实验1和2中,NaOH溶液的作用是_______________(用化学方程式表示)。
(2)实验1的目的是______________。
(3)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是__________(填编号)。
(4)由上述实验可推知,镁条变黑的条件是_______________。
【反思与评价】
(5)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是______________。
(6)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是__________。
查看答案和解析>>
科目: 来源: 题型:解答题



查看答案和解析>>
科目: 来源: 题型:解答题
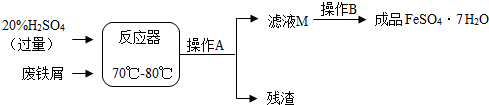
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
查看答案和解析>>
科目: 来源: 题型:解答题
 利用如图所示的装置进行碱式碳酸铜加热分解的实验.试回答:
利用如图所示的装置进行碱式碳酸铜加热分解的实验.试回答:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图表示的是地壳里所含各种元素的质量分数.请据图回答下列问题;
如图表示的是地壳里所含各种元素的质量分数.请据图回答下列问题;查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com