
科目: 来源: 题型:选择题
| A. | CO作还原剂 | B. | Fe2O3被氧化 | ||
| C. | CO发生了还原反应 | D. | 该反应是置换反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室用如图所示装置还原CuO,从A处通入CO,B处是CuO,C处是澄清石灰水,根据实验现象,回答下列问题:
实验室用如图所示装置还原CuO,从A处通入CO,B处是CuO,C处是澄清石灰水,根据实验现象,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B为两种黑色粉末,A为金属氧化物,D为红色单质,A、B、C、D、E五种物质之间的转化关系如图所示.请回答:
已知A、B为两种黑色粉末,A为金属氧化物,D为红色单质,A、B、C、D、E五种物质之间的转化关系如图所示.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 第一次 | 第二次 | 第三次 |
| 氧气的质量 | 7g | 8g | 10g |
| 生成SO2的质量 | 14g | 16g | 16g |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
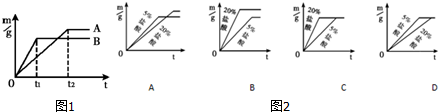
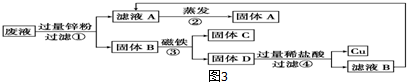
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应物均是单质 | B. | 生成物均是氧化物 | ||
| C. | 生成物均是气体 | D. | 反应时均产生蓝色火焰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com