
科目: 来源: 题型:
【题目】以下有关氧气的说法正确的是( )
A.液态氧可用作火箭的燃料
B.往食品包装中充入氧气,可以防止食品变质
C.可燃物在氧气中燃烧通常比在空气中剧烈
D.鱼能在水中生存,证明氧气易溶于水
查看答案和解析>>
科目: 来源: 题型:
【题目】“水是生命的源泉”。下面对水化学式(H2O)意义的理解,错误的是( )
A.水是由氢、氧两种元素组成的
B.水分子中含有氢、氧两种原子
C.水分子中氢、氧原子个数比为2:1
D.水分子中含有两个氢原子、一个氧原子
查看答案和解析>>
科目: 来源: 题型:
【题目】关于催化剂的下列说法中,正确的是( )
A. 化学反应后催化剂本身的质量减少
B. 化学反应后催化剂本身的质量增加
C. 催化剂可改变化学反应速率
D. 化学反应后催化剂的化学性质发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】一直带2个单位正电荷的某离子核外有18个电子,它的相对原子质量为40,则下列说法正确的是( )
A.该元素位于周期表第三周期 B.该粒子中子数为20
C.该粒子核电荷数为18 D.该粒子质子数为18
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。某兴趣小组同学对其进行探究。
一、过氧化钙的性质研究
(1)取少量过氧化钙放入试管中,加足量水,产生无色气泡,将带火星的木条伸进试
管中,观察到带火星的木条 ,说明过氧化钙与水反应有氧气生成。
(2)分别取实验(1)静置后的上层清液少量于两支试管中,向其中一支试管中滴入酚酞试液,发现溶液变成红色,说明溶液呈 性;向另一支试管中通入二氧化碳,溶液变浑浊,说明过氧化钙与水反应还有氢氧化钙生成。
结论:过氧化钙和水反应生成氢氧化钙和氧气。
二、过氧化钙的制备研究
实验室用钙盐制备CaO2,其主要实验装置(图1)和流程(图2)如下:
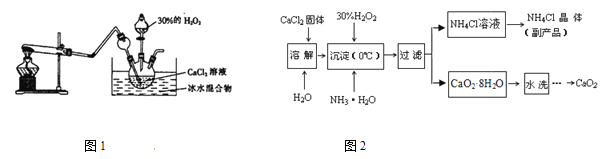
(3)图1试管中的物质是NH4Cl和Ca(OH)2,加热时发生反应生成CaCl2、NH3 和H2O,
反应的化学方程式为 。
(4)“沉淀”时发生的反应为:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl,需
要控制温度在0℃左右,采用的操作是将反应容器放置在 中,反应温度不能过高
的原因是:①防止氨水挥发;② 。
(5)“过滤”所得的副产品NH4Cl可做化肥中的 肥。检验“水洗”已经洗净的方
法是:取最后一次洗涤液少量于试管中, 。
(6)加热分解法是测定CaO2产品纯度的常用方法之一(2CaO2 ![]() 2CaO+O2↑)。
2CaO+O2↑)。
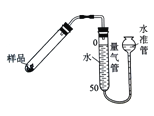
右图是实验室测定产品中CaO2纯度的装置。实验步骤:检查装置的气密性→装填药品0.30g→调节量气管和水准管两边水位相平→加热至不再有气体放出→冷却至室温,调节量气管和水准管两边水位相平→读数→再重复2次,取平均值,计算。(已知:该温度和压强下的O2密度为1.43g/L)
根据下表数据,计算CaO2产品纯度(请写出计算过程)。
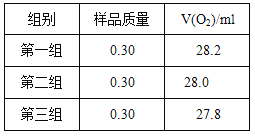
若样品质量用wg表示,反应前称量药品和小试管总质量为mg,反应后在空气中冷却,称量药品和小试管总质量为ng,则CaO2纯度![]() ,此方案测定结果偏小的原因可能是 。
,此方案测定结果偏小的原因可能是 。
[
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验装置图,回答有关问题。

(1)图中标有①的仪器名称是 。
(2)实验室用高锰酸钾制取氧气,选用的发生装置是 (填字母),若要获得较纯净的氧气,应选用的收集装置是 (填字母),反应的化学方程式为 。利用收集到的氧气做“铁丝在氧气中燃烧”的实验,反应的化学方程式为 。
(3)实验室制取二氧化碳,加入药品前一定要先检查装置的 ,反应的化学方程式为 ,用F装置收集二氧化碳,二氧化碳应从 端通入(填“a”或“b”)。
(4)氯气是一种黄绿色的有毒气体,密度比空气大,生活中可用于自来水的杀菌消毒。
已知:①氯气溶于水得到的溶液叫氯水,发生反应:Cl2+H2O=HCl+HClO,新制的氯水能
![]() 使有色布条褪色(漂白);②氯气能与氢氧化钠溶液反应:+2NaOH=NaCl+NaClO+H2O。小明为探究起漂白作用的物质是次氯酸(HClO),设计了右图所示的实验:打开止水夹,通氯气一段时间,观察到 (填“A”或“B”)中布条褪色,装置C中盛放的试剂是 。小明设计的方案不能够证明起漂白作用的是次氯酸,请补充实验帮助他达到实验目的(写出实验步骤、现象及结论) 。
使有色布条褪色(漂白);②氯气能与氢氧化钠溶液反应:+2NaOH=NaCl+NaClO+H2O。小明为探究起漂白作用的物质是次氯酸(HClO),设计了右图所示的实验:打开止水夹,通氯气一段时间,观察到 (填“A”或“B”)中布条褪色,装置C中盛放的试剂是 。小明设计的方案不能够证明起漂白作用的是次氯酸,请补充实验帮助他达到实验目的(写出实验步骤、现象及结论) 。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铵(NH4Cl)是一种氮肥,有促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量的作用。氯化铵中氮元素的化合价是
A.+1 B.+3 C.+5 D.-3
查看答案和解析>>
科目: 来源: 题型:
【题目】化学就在我们身边,它与我们的生活息息相关。
(1)现有H、C、O、Na、Cl五种元素,请选用其中的元素写出下列物质的化学式:
①人体胃液中含有的酸 ;②天然气的主要成分 ;
③能供给呼吸的气体 ;④发酵粉的主要成分小苏打 。
(2)2016年3月20日无锡国际马拉松赛事的口号是:“人在画中跑”,这幅美丽的画卷指
的就是太湖。某同学对太湖水的水样进行了相关研究。

①可以采用 来测定湖水的酸碱度。
②自制简易净水器净化湖水,其中活性炭起到 和过滤的作用。
③日常生活中为了降低水的硬度,常采用的方法是 。
④下图中表示节水标志的是 (填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化铜矿石含有CuO、Cu2(OH)2CO3和Fe2O3,还含有一些不溶于水、不溶于酸的其他杂质。铜、铁是畜禽所必需的微量元素,某饲料厂联合生产硫酸铜晶体和硫酸亚铁晶体的主要工艺流程如下。
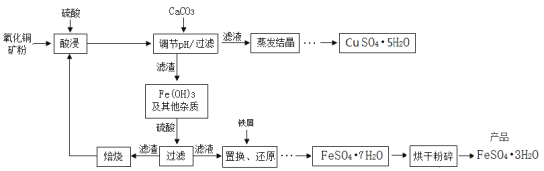
【资料】Cu2+、Fe3+以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 1.5 | 4.2 |
沉淀完全的pH | 3.7 | 6.7 |
请回答问题:
(1)氧化铜矿石粉碎的目的是 。
(2)写出“酸浸”中发生反应的化学方程式 (任写一个)。
(3)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有烧杯、玻璃棒和 。
(4)右图为“硫酸亚铁干燥曲线图”,据此可确定由FeSO4·7H2O脱水得到流程中所示产品的适宜工艺条件为 、 (分别指出温度和时间)。

(5)在“调节pH/过滤”中,加入CaCO3调节溶液的pH,请说出溶液适宜的pH范围是多少并说明理由 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象描述正确的是
A.硫酸铵与熟石灰固体混合研磨,有刺激性气味的气体产生
B.铜丝插入硫酸铝溶液中,溶液由无色变为蓝色
C.点燃棉线,会闻到烧焦羽毛的气味
D.硫在氧气中燃烧,发出蓝紫色火焰,放出热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com