
科目: 来源: 题型:
【题目】物质的分类有多种标准,现有下列各种物质,请按要求填空:
①空气 ②冰水混合物 ③过氧化氢溶液 ④氯酸钾 ⑤氧气
分类标准 | 混合物 | 单质 | 氧化物 | 气体 | |
属于该类的物质(填序号) | ②④⑤ |
查看答案和解析>>
科目: 来源: 题型:
【题目】某废旧金属中含有铜、金(Au)和镍(Ni),回收Au并制备CuSO45H2O晶体的流程如下:
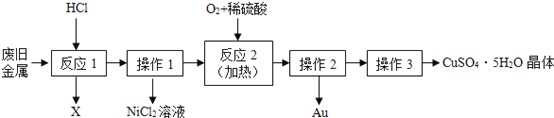
下列说法正确的是( )
A.反应1的生成物为H2O
B.操作1和操作2用到玻璃仪器为漏斗、烧杯和玻璃棒
C.三种金属的金属活动性顺序为:Cu>Ni>Au
D.反应2的化学方程式为:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O
2CuSO4+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】用硫酸铜进行如图所示的实验,对所得溶液的分析正确的是( )

A. 三个溶液中溶质溶解度一样 B. ②溶液是不饱和溶液
C. ③溶液颜色最深 D. 烧杯中溶液的溶质质量分数大小关系为③>①≥②
查看答案和解析>>
科目: 来源: 题型:
【题目】四位同学用氢氧化钠溶液和稀盐酸探究中和反应,请你参与以下探究:

(1)甲组同学利用数字化传感器测定烧杯中溶液pH的变化过程图像(如图)。由图可知,甲同学将_____________溶液加入到另一溶液中。若原溶液中滴有酚酞试液,B点对应的实验现象是_____________。
(2)乙同学取少量的氢氧化钠溶液于烧杯中,用酸度计测得该溶液的pH同时插入一支温度计,测量溶液的温度(如图)。根据温度随pH变化的图像(如图),判断该反应属于__________(选填“吸热”或“放热”)反应。B点比A点的温度低的原因是_____________。
(3)丙同学用另一瓶久置的氢氧化钠溶液进行上述实验时,发现有少量的气泡冒出。请写出产生气泡反应的化学方程式是_____________。若另取该溶液,滴加酚酞试液变红,_____________(选填“能”或“不能”)说明该氢氧化钠溶液为部分变质。
(4)丁同学对本地化工厂废水池中的氯化氢含量进行了测定(如图)。取废水100 g,用质量分数为20%的氢氧化钠溶液进行中和,通过计算知道废水中氯化氢的质量分数为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 墙内开花墙外香说明分子在不断运动
B. 保持空气化学性质的最小粒子是空气分子
C. 检验氢氧化钠与氯化铵反应生成的气体可用湿润的蓝色石蕊试纸
D. 不同种元素最本质的区别是中子数不同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于空气的说法中,正确的是
A. 100g空气中有78g氮气
B. 空气质量级别数目越大,空气的质量越好
C. 医疗上用液氮冷冻麻醉
D. 分离液态空气法制氧气属于分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】日常生活中的下列做法,与其他三个有本质区别的是( )
A. 用食醋去除水壶中的水垢 B. 用活性炭去除装修后房内的异味
C. 用含有氢氧化钠的厨房清洁剂清洗油污 D. 用含有小苏打的发酵粉烘制糕点
查看答案和解析>>
科目: 来源: 题型:
【题目】水是生命之源,我们应该了解水、爱护水资源。下列说法错误的是 ( )
A. 净水的方法通常有沉淀、过滤、吸附和蒸馏。
B. 自来水厂常用ClO2消毒,ClO2中氯元素的化合价为+4
C. 通过过滤的方法可以将不溶于水的固体杂质与水分离开来
D. 电解水时,产生氢气、氧气的体积比为1:2,质量比为1:8.
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸铜可用于生产木材防腐剂等。工业上常在含有硫酸铜的废水中加入碳酸钠溶液,得到碱式碳酸铜沉淀。
(1)产品生产中加入Na2CO3溶液时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如图所示,沉淀时溶液pH最好控制在_________左右。
(2)实验探究
Ⅰ.验证碱式碳酸铜的分解产物,可选装置如图所示。

甲同学将装置按BCA的顺序组合进行实验,装置A中盛放的试剂的作用是___________,装置C中的现象为___________。装置C、A顺序不能颠倒的原因是___________。
实验结束,B装置中粉末完全变黑。关于黑色物质的成分,有人认为可能有碳,请从物质的物理性质和元素守恒角度说明此猜想的依据是_____________。
乙同学为确认该黑色粉末是氧化铜而不是碳粉,设计如下实验,请完成下表:
实验步骤 | 观察到的现象 | 获得结论 | 反应的化学方程式 |
取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 | _______ | 黑色粉末均为氧化铜 | _______ |
Ⅱ.丙同学探究CO还原CuO所得固体产物的成分,实验装置如下图:

资料:CO还原CuO的实验过程中,固体产物可能有Cu2O(红色固体)、Cu。
反应前 | 反应后 |
玻璃管和内盛氧化铜 粉末的总质量为62.0 g | 玻璃管和内盛红色 粉末的总质量为61.7 g |
玻璃管的质量为60.0 g | |
(1)打开K,缓缓通入CO气体,一段时间后加热。当黑色固体全部变红后停止加热,继续通入CO气体直至玻璃管冷却。
①由实验数据计算可知,CuO中铜元素的质量为_________g,红色固体粉末成分为_________。
②下列有关该实验的说法正确的是_____________。
A.先通入一会CO再加热是为了排净装置中的空气
B.实验结束必须先将玻璃管与虚线框内的装置分开,防止溶液倒吸
C.装置图中虚线框内的装置既能吸收二氧化碳,又能收集一氧化碳
D.排入到烧杯中的溶液可能显碱性,也可能显中性
Ⅲ.工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。为测定某种产品的组成,丁同学设计的实验方案中有如下步骤:①称取12.0 g的样品;②高温分解;③测出生成CO2的质量为2.2 g;④测出生成水蒸气的质量为1.8 g。请根据实验数据,计算确定该碱式碳酸铜的化学式。写出计算过程。_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com