

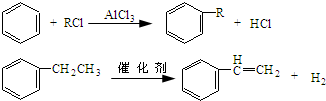
 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$ +HCl.
+HCl.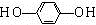 .
. 分析 (1)甲含有碳碳双键和酯基等官能团;
(2)根据甲的同分异构体不含甲基的羧酸有链状和环状分析;
(3)淀粉水解得到A为葡萄糖,葡萄糖转化生成乙醇,乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷水解生成乙二醇;(4)乙烯与HCl发生加成反应生成CH3CH2Cl,由信息可知,苯与CH3CH2Cl发生取代反应生成乙苯,乙苯在催化剂的作用下生成苯乙烯;
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110,丁与FeCl3溶液作用显现特征颜色,分子中含有酚羟基-OH,结合相对分子质量,可知丁含有1个苯环,假设为二元取代,则剩余的式量为110-Mr(OH)-Mr(C6H4)=17,故剩余基团为-OH,烃基上的一氯取代物只有一种,说明苯环中只有1种H原子,2个-OH处于对位,据此生成丁的结构简式.
解答 解:(1)甲含有碳碳双键和酯基等官能团,不含氧的官能团为碳碳双键,故答案为:碳碳双键;
(2)甲的同分异构体中不含甲基有呈环状的、也有呈链状的,如不含甲基的链状羧酸为CH2=CH-CH2-CH2-COOH,
故答案为:CH2=CHCH2CH2COOH;
(3)淀粉水解生成A为葡萄糖,葡萄糖转化生成乙醇,乙醇发生消去反应生成乙烯,乙烯与溴的四氯化碳溶液发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷水解生成乙二醇,则:A的分子式是C6H12O6,试剂X可以是Br2/CCl4,
故答案为:C6H12O6;Br2的CCl4溶液;
(4)乙烯与HCl发生加成反应生成CH3CH2Cl,由信息可知,苯与CH3CH2Cl发生取代反应生成乙苯,乙苯在催化剂的作用下发生消去反应生成苯乙烯,属于取代反应的化学方程式为: +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$ +HCl,
+HCl,
故答案为: +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$ +HCl;
+HCl;
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110,丁与FeCl3溶液作用显现特征颜色,分子中含有酚羟基-OH,结合相对分子质量,可知丁含有1个苯环,假设为二元取代,则剩余的式量为110-Mr(OH)-Mr(C6H4)=110-17-76=17,故剩余基团为-OH,烃基上的一氯取代物只有一种,说明苯环中只有1种H原子,2个-OH处于对位,故丁的结构简式为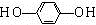 ,
,
故答案为: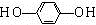 .
.
点评 本题考查有机物的推断与合成,涉及有机反应类型、同分异构体、反应方程式书写、官能团的性质等,是对所学知识的综合考查,较好的考查学生的思维能力,(5)中注意根据相对分子质量结含有的官能团,利用残余法确定其结构简式,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH2OH | C. | CH3CH(OH)COOH | D. | CH3CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷和乙醇均能发生取代反应 | |
| B. | 蛋白质、淀粉、油脂均能发生水解反应 | |
| C. | 溴乙烷与NaOH水溶液共热生成乙烯 | |
| D. | 油脂和淀粉都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
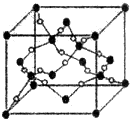 A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.
A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.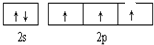 ,与AC3分子互为等电子体的阳离子为H3O+;
,与AC3分子互为等电子体的阳离子为H3O+;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com