
 A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.
A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.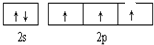 ,与AC3分子互为等电子体的阳离子为H3O+;
,与AC3分子互为等电子体的阳离子为H3O+;分析 根据题意,A、B、C、D、E、F、G为原子序数依次增大的短七种短周期主族元素,B原子核外电子分处3个不同能级,则B为C,D原子p轨道成对电子数等于未成对电子数,P亚层三个轨道中的电子数只能是2、1、1共四个电子,核外电子排布式1S22S22P4,所以核外电子总数为8,D元素是O元素;C的原子序数介于B、D之间,所以C为N元素,A与C能形成AC3分子且VSEPR模型为四面体形,则A为H元素,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期,则E为Mg,F为Al,G是第四周期的元素,最外层电子数与A相同且内层均填充满电子,则G为Cu元素,根据推断出的元素进行解答.
解答 解:根据题意,A、B、C、D、E、F、G为原子序数依次增大的短七种短周期主族元素,B原子核外电子分处3个不同能级,则B为C,D原子p轨道成对电子数等于未成对电子数,P亚层三个轨道中的电子数只能是2、1、1共四个电子,核外电子排布式1S22S22P4,所以核外电子总数为8,D元素是O元素;C的原子序数介于B、D之间,所以C为N元素,A与C能形成AC3分子且VSEPR模型为四面体形,则A为H元素,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期,则E为Mg,F为Al,G是第四周期的元素,最外层电子数与A相同且内层均填充满电子,则G为Cu元素,
(1)C为N元素,C的基态原子的价电子排布图为 ,与HN3分子互为等电子体的阳离子为 H3O+,
,与HN3分子互为等电子体的阳离子为 H3O+,
故答案为: ;H3O+;
;H3O+;
(2)E为Mg,F为Al,由于镁原子结构中各亚层均处于全满状态,能量低稳定,所以镁比铝的第一电离能高,由于镁离子半径大于铝离子,且在铝中自由电子比镁多,所以铝中金属键比镁强,所以铝的硬度大于镁,
故答案为:>;镁原子结构中各亚层均处于全满状态,能量低稳定;<;镁离子半径大于铝离子,且在铝中自由电子比镁多,所以铝中金属键比镁强;
(3)光谱证实单质AI与强碱性溶液反应有[AI(OH)4]-生成,可看作其中铝原子和三个羟基形成三对共用电子对,形成三个极性共价键,形成AI(OH)3;AI(OH)3溶解在强碱中,和OH-形成[AI(OH)4]-,利用的是铝原子的空轨道和氢氧根离子的孤对电子形成的配位键;由两个相同或不相同的原子轨道沿轨道对称轴方向相互重叠而形成的共价键,叫做σ键,所以[AI(OH)4]-中也形成了σ键.
故答案为:ace;
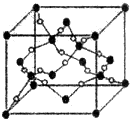
(4)根据BD2即CO2在高温高压下所形成的晶胞晶胞结构可知,碳原子和氧原子以单键形成了立体网状结构,所以该晶体为原子晶体,根据晶胞中碳原子和氧原子的结构可知,碳原子的价层电子对数为$\frac{4+4}{2}$=4,所以C原子的杂化方式为SP3杂化,氧原子的价层电子对数为$\frac{6+2}{2}$=4,所以O原子的杂化方式为SP3杂化,
故答案为:原子;sp3;sp3;
(5)G为Cu元素,是29号元素,所以其基态原子的电子排布式为1s22s22p63s23p63ds104s1,Cu元素位于元素周期表的 ds区,Cu单质晶体中原子的堆积方式为面心立方最密堆积,所以每个晶胞中含有铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,所以铜的密度ρ=$\frac{\frac{4×M}{{N}_{A}}}{{a}^{3}}$g•cm-3=$\frac{4M}{{N}_{A}{a}^{3}}$g•cm-3,
故答案为:1s22s22p63s23p63ds104s1; ds;$\frac{4M}{{N}_{A}{a}^{3}}$.
点评 本题考查了原子核外电子排布、电负性电离能的概念含义和应用、等电子体、化学键形成、原子轨道杂化方式和类型、氢键的实际应用,元素周期表的应用等知识,综合性较大.


科目:高中化学 来源: 题型:解答题

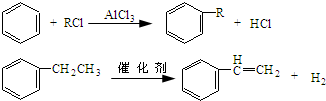
 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$ +HCl.
+HCl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6的有机物最多存在3个碳碳单键,与C4H10的碳碳单键数相同 | |
| B. |  和 和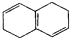 均是芳香烃, 均是芳香烃,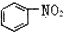 是芳香族化合物 是芳香族化合物 | |
| C. | 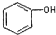 和 和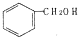 分子组成相差一个-CH2-,因此是同系物 分子组成相差一个-CH2-,因此是同系物 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可用溴水鉴别苯、乙醇、1-己烯、乙酸溶液和苯酚溶液 | |
| B. | 分子式为C7H8O的芳香族化合物有5种,能与碳酸钠溶液反应的有4种 | |
| C. | 人体需要的营养素主要有:蛋白质、脂类、糖类、无机盐、维生素和水 | |
| D. | 将溴乙烷与氢氧化钠乙醇溶液共热产生的气体通入高锰酸钾酸性溶液后,溶液褪色,即证明有乙烯生成 | |
| E. | 分子式为C4H10O,能催化氧化为醛的有机物的核磁共振氢谱图有可能为2个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com