
【题目】完成下列变化的化学方程式,并按要求填空。
(1)红磷在空气中燃烧:_____,红磷燃烧时放出大量热,产生大量_____。
(2)稀盐酸除去铁锈:_____,溶液由无色变为_____。
(3)葡萄糖在动物体内酶的催化下缓慢氧化:_____,反应时_____(填“放出”或“吸收”)热量。
(4)硫酸铵与熟石灰混合研磨:_____,反应仪器是_____。
科目:初中化学 来源: 题型:
【题目】在已平衡的天平两边分别放一个等质量的烧杯,烧杯中装有等质量、等质量分数的足量稀盐酸,在左边烧杯中加入5.6g金属铁,在右边烧杯中加入5.5g镁和铜的混合物,充分反应后天平仍然保持平衡,则右边烧杯中加入的混合物中镁和铜的质量比为( )
A. 36:19 B. 12:43 C. 24:31 D. 13:42
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】市场上的加碘食盐通常加入的是碘酸钾(KIO3),替代了原来的碘化(KI),因为碘化钾容易被氧气氧化。为探究不同条件下KI与O2的反应,进行如下系列实验。
(查阅资料)①碘单质(I2)遇淀粉液变蓝。②部分酸、碱、盐通常在水溶液中以离子形式存在,如:盐酸中存在H+和Cl-。
(进行实验)
实验1 将不同浓度的KI溶液置于纯氧中,放置相同时间后观察,现象如下表:
装置 | 烧杯中的液体 | 现象 |
| ①2 mL 0.15%KI溶液+5滴淀粉液 | 无明显变化 |
②2 mL 1.5%KI溶液+5滴淀粉液 | 溶液变蓝 | |
③2 mL 15%KI溶液+5滴淀粉液 | 溶液变蓝,颜色较②深 |
实验2 将相同浓度的KI溶液加入不同浓度的稀盐酸后置于纯氧中,5分钟后观察,现象如下表:
装置 | 烧杯中的液体 | 现象 |
| ④ 2 mL 15%KI溶液+5滴淀粉液+2mL蒸馏水 | 无明显变化 |
⑤ 2 mL 15%KI溶液+5滴淀粉液+2 mL1% 盐酸 | 溶液变蓝 | |
⑥ 2 mL 15%KI溶液+5滴淀粉液+2 mL 10% 盐酸 | 溶液变蓝,颜色较⑤深 |
(解释与结论)
(1)实验1的目的是___________________________。
(2)实验2中通过对比⑤和⑥,得出的结论是______________________。
(3)实验2中,KI在盐酸的作用下与O2反应的化学方程式如下,补全该反应的化学方程式:4KI+O2+4HCl=4KCl+2______+________。
(反思与评价)
(4)实验④中加2mL蒸馏水的作用是_____________________。
(5)某同学将实验⑥中2 mL10% 盐酸替换成2 mL10% NaCl溶液,5分钟后溶液颜色无明显变化,从离子角度分析,由此得出的结论是_________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一种人工合成的超重化学元素,元素符号为 Ts,元素名称为![]() ,下列说法正确的是
,下列说法正确的是

A. 中子数 117
B. 质子数 293
C. 相对原子质量是 176
D. 属于非金属元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下水道堵塞是日常生活中经常遇到的问题,下水管里的淤积物主要为油污、食物残渣、毛发等。“管道通”可使堵塞的管道畅通无阻。化学兴趣小组对“管道通”中的物质进行了探究:

(查阅资料)
(1)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西,常用于疏通管道。
(2)铝粉呈银白色。铝粉与强酸、强碱溶液都能迅速反应放出氢气,同时放出大量热。
①铝与盐酸反应的化学方程式为_____。
②铝与氢氧化钠溶液反应的化学方程式为_____=2NaAlO2+3H2↑
(1)(猜想与验证)打开一盒“管道通”,内有一袋白色固体颗粒和一袋银白色粉末。
(1)猜想:白色固体颗粒为氢氧化钠。
实验操作 | 实验现象 |
①将几粒白色颗粒放在表面皿上,露置在空气中片刻。 | _____ |
②将几粒白色颗粒放入盛有少量水的试管中,并用手触摸试管外壁。 | 试管外壁温度升高 |
③向步骤②得到的溶液中放入一段羊毛线,加热一段时间。 | 羊毛线缩小 |
结论:白色固体颗粒为氢氧化钠。
(2)猜想:银白色粉末为铝粉。
实验操作 | 实验现象 |
①取少量该粉末于洁净的试管中,滴加稀盐酸,用手触摸 试管外壁,点燃反应产生的气体 | 产生大量气泡,试管外壁温度明显升高,气体燃烧产生淡蓝色火焰。 |
②取少量该粉末于洁净的试管中,滴加_____,用手触摸 试管外壁,点燃反应产生的气体 |
结论:银白色粉末为铝粉。
(应用)
(2)使用“管道通”时,先将银白色粉状固体添加入被堵塞的管道中,再加入白色固体颗粒,倒入一杯水,堵上管道口。管道内可能出现的现象是_____.(填序号)
A.管道内温度明显升高
B.产生大量气体
C.管道被疏通
(3)“管道通”内的两种物质必须密封保存,否则会发生变质。用化学方程式表示其中的原因:_____、_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学符号填空:
(1)空气中含量最多的气体是:___;
(2)写出硫酸钠的化学式并标出钠元素的化合价___;
(3)2个氧原子:___
(4)某微粒的结构示意图为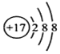 ,该微粒的符号___;
,该微粒的符号___;
(5)含有10个电子且带两个单位正电荷的阳离子___;
(6)保持二氧化碳化学性质的最小微粒___;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.
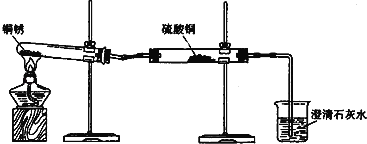
探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3.②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
【进行实验1】同学们设计了如图所示装置并进行实验.
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 ; 铜绣由 元素组成; 烧杯中发生反应的化学方程式为 . |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 . (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 |
实验2 |
| ||
实验3 |
| ||
实验4 |
| 铜生锈的条件是
|
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图提供的实验装置回答问题:
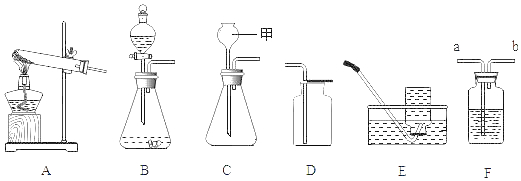
(1)图C装置中,甲仪器的名称是_____。
(2)实验室将双氧水加入二氧化锰粉末制取氧气,发生装置是_____(填序号),反应的化学方程式为_____,若用E装置收集氧气,当有_____时,开始收集气体。
(3)实验室可以按照“B→F→F→真空气囊”的装置顺序制取纯净的CO2气体,B装置中发生反应的化学方程式为_____,第一个F装置盛放试剂的作用是_____,第二个F装置盛放的试剂为_____,混合气应由_____端通入。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com