
| A. | 滤渣中一定有镁、铜 | |
| B. | 滤渣中一定有镁、锌、铜 | |
| C. | 滤液中一定有硫酸铜和硫酸锌 | |
| D. | 滤液中一定有硫酸镁,一定没有硫酸铜 |
分析 金属活动性是镁>锌>铜,所以镁先与硫酸铜溶液反应,当镁反应完才有锌与硫酸铜溶液的反应,故滤渣中应该是锌、铜,可能有镁;滤液中一定有硫酸镁,一定没有硫酸铜,可能有硫酸锌.
解答 解:A、滤渣中一定有镁和硫酸铜反应生成的铜,向滤渣中加入足量的稀盐酸,滤渣部分溶解且有气体生成,说明滤渣中一定含有锌,可能含有镁,该选项说法不正确;
B、由A分析可知,滤渣中一定有镁和硫酸铜反应生成的铜,一定含有锌,可能含有镁,该选项说法不正确;
C、滤液中一定含有镁和硫酸铜反应生成的硫酸镁,向滤渣中加入足量的稀盐酸,滤渣部分溶解且有气体生成,说明滤渣中一定含有锌,进一步说明滤液中一定不含有硫酸铜,该选项说法不正确;
D、滤液中一定含有镁和硫酸铜反应生成的硫酸镁,向滤渣中加入足量的稀盐酸,滤渣部分溶解且有气体生成,说明滤渣中一定含有锌,进一步说明滤液中一定不含有硫酸铜,该选项说法正确.
故选:D.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 53:40 | B. | 53:19 | C. | 53:80 | D. | 53:28 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向一定量的NaOH溶液中通入CO2后再滴加稀盐酸,有气体生成 | |
| B. | 向装有一定量NaOH溶液的烧杯中滴几滴酚酞溶液,再逐滴加入稀盐酸 | |
| C. | 先测定NaOH溶液的pH,再逐滴加入稀盐酸,溶液的pH数值逐渐降低 | |
| D. | 向装有少量稀盐酸的试管中滴加足量NaOH溶液,再向其中滴加Na2CO3溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
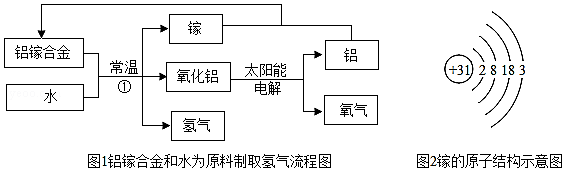
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
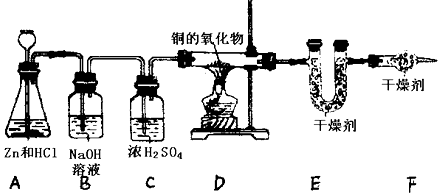
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
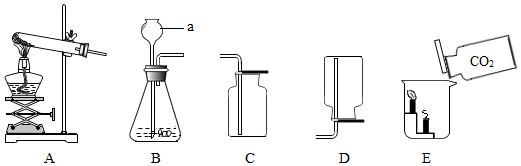

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com