
【题目】水与人类的生活和生产密切相关,请回答下列问题:
(1)海水淡化可缓解淡水资源匮乏的问题,如图为太阳能海水淡化装置示意图。
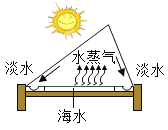
①水变成水蒸气的过程中,不发生变化的是____ (填字母序号)。
A 分子质量
B 分子种类
C 分子间隔
②利用该装置将一定量的海水暴晒一段时间后, 剩余海水中氯化钠的质量分数会_____(填“变大”、“变小”或“不变”) .
(2)甲、乙、丙三种固体物质的溶解度曲线如下图所示。请回答:
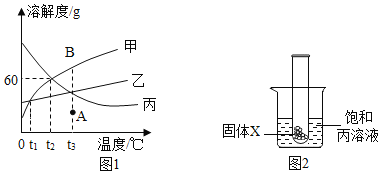
①0°C时,三种物质中溶解度最大的是____________。
②t2°C时,在盛有50g水的烧杯中加入35g甲物质,充分搅拌后所得溶液的质量是_____g.
③将t3°C的甲、乙、丙三种物质的饱和溶液降温到t1°C时,所得溶液中溶质的质量分数关系为__ (用“=”“<”或“> ”符号连接)
④将甲溶液由A点转变为B点,可采用的方法是__ (填一种即可) .
⑤如图2,将放有固体X的试管放入烧杯中,然后向试管内加入液体Y,一段时间后丙溶液中有固体析出,则对应的X和Y物质是______(填序号)。
A 氯化钠和水
B 镁条和稀盐酸
C 硝酸铵和水
D氢氧化钠和水
【答案】AB 变大 丙 80 丙>甲=乙 加入甲溶质 BD
【解析】
①水变成水蒸气的过程中,水的状态发生变化,没有新物质生成,分子质量和分子种类不发生变化,分子间隔变大,故选AB。
②利用该装置将一定量的海水暴晒一段时间后,水分蒸发,溶剂质量减小,剩余海水中氯化钠的质量分数会变大。
(2)甲、乙、丙三种固体物质的溶解度曲线如下图所示。请回答:
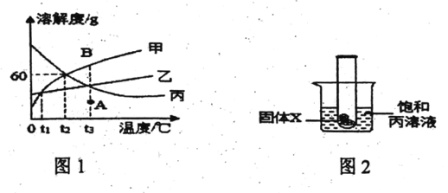
①通过分析溶解度曲线可知,0℃时三种物质中溶解度大小关系为:丙>乙>甲,0℃时溶解度最大的是丙;
② t2°C时,甲物质的溶解度是60g,所以在盛有50g水的烧杯中加入35g甲物质,充分搅拌后,最多溶解30g,所得溶液的质量是:80g;
③将t3°C的甲、乙、丙三种物质的饱和溶液降温到t1°C时,甲、乙均有晶体析出,变为t1°C时的饱和溶液,丙的溶解度随温度的降低而增大,降温后丙变为不饱和溶液,质量分数等于t3°C丙的饱和溶液的质量分数,根据饱和溶液质量分数的计算:![]() ,故所得溶液中溶质的质量分数关系为丙>甲=乙;
,故所得溶液中溶质的质量分数关系为丙>甲=乙;
④A点代表甲的不饱和溶液,B点代表甲的饱和溶液,将甲溶液由A点转变为B点,可采用的方法是加入甲溶质;
⑤丙物质的溶解度随温度的升高而减小,所以将放有固体X的试管放入烧杯中,然后向试管内加入液体Y,一段时间后丙溶液中有固体析出,说明溶液的温度升高,
A、氯化钠和水,溶液温度不变,故错误;
B、镁条和稀盐酸,反应放热,溶液温度升高,故正确;
C、硝酸铵和水,溶液温度降低,故错误;
D、氢氧化钠溶于水,溶液温度升高,故正确。
故选BD。


科目:初中化学 来源: 题型:
【题目】工业上以黄铁矿(主要成分是FeS2)为原料,生产硫酸的简要流程图如下:
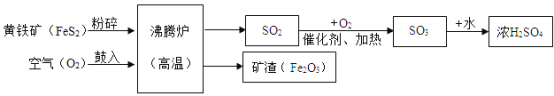
(1)写出流程图中一种氧化物的名称_____。
(2)将黄铁矿粉碎,目的是_____。
(3)请写出黄铁矿在沸腾炉里发生的化学反应方程式____。该反应中的____(填元素符号)从反应前到反应后化合价升高。
(4)该生产流程的炉渣可以做工业炼铁的原料,请写出工业炼铁反应化学方程式______。此外古代记载的湿法冶金技术有“曾青得铁则化为铜”,写出有关化学方程式________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐是九年级化学学习的重要知识,并且它们具有广泛的用途。
(1)下列关于酸、碱、盐的生产或应用中的说法合理的是_________。
A将氯化铵与草木灰混合施用
B烧碱既可以从内陆盐湖提取,又可用侯氏联合制碱法制取
C用小苏打治疗胃酸过多
D高温煅烧生石灰可以得到熟石灰
(2)盐酸和硫酸是初中化学常见的酸,它们有很多相似的化学性质,因为其溶液中都含有______(填离子符号)。打开盛放浓硫酸和浓盐酸的试剂瓶盖后,立即就能把它们区分开来,原因是什么?______
(3)现象不明显的化学反应通过数字化实验技术可以实现反应过程的“可视化”。某兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测得反应过程中溶液的pH变化情况如图所示。
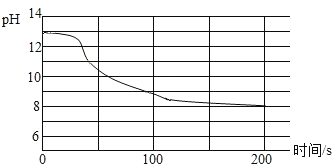
①写出二氧化碳与氢氧化钠反应的化学方程式:__________。
②溶液pH始终都大于7,原因是________。
(4)为了除去氯化钠溶液中含有的CaCl2和MgSO4杂质,先向溶液中加入过量的Ba(OH)2溶液和过量的Na2CO3溶液,充分反应后过滤,则滤渣中含有的物质为________;向滤液加入适量稀盐酸,将反应所得溶液蒸发结晶,即可得到纯净的氯化钠固体。则在蒸发操作时用玻璃棒搅拌的目的是______。
(5)10g碳酸钙与100g稀盐酸正好完全反应,生成4.4g二氧化碳,则反应所得氯化钙溶液的溶质质量分数为多少(准确到0.1%)?______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料广泛应用于生活和生产中。
(1)我国已步入高铁时代,高铁的机身采用铝合金材料,下列属于该合金性质的是_ (填字母)。
A 硬度大
B 密度大
C 耐腐蚀
(2)某些铁制零件防锈措施是涂油,其防锈原理是__。工人师博常用稀硫酸除铁锈,其反应的化学方程式是___。
(3)保护金属资源的有效途径之一是废旧金属的回收和利用,其意义在于___(答出一点即可)。
(4)向硝酸银和硝酸镁的混合溶液中加入一定量的铁粉,观察到溶液由无色变为浅绿色后,对混合物进行过滤,则滤液中一定含有的溶质是__(用化学式表示) 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“宏观辨识与微观探析”是化学学科的核心素养之一。下列说法正确的是
①化学变化中,分子和原子的种类都不发生改变
②冰雪融化的过程中水分子之间的间隔发生了变化
③同种分子构成的物质是纯净物
④3Fe2+和3N中的“3”都表示微粒的个数
⑤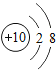 、
、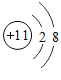 和
和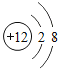 表示的微粒都带电荷
表示的微粒都带电荷
A.①②⑤
B.②③⑤
C.②③④
D.②④⑤
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019 年年末,高传染性“新冠肺炎”在我国部分地区流行。进行合理的药物消毒是预防新冠病毒感染的重要手段之一。过氧乙酸是较为有效的一种消毒剂,其化学式为CH3OOOH,根据过氧乙酸的化学式进行计算。
(1)过氧乙酸中所含元素质量分数最小的是 (写元素名称)。
(2)计算过氧乙酸中碳、氢、氧元素的质量比。(最简整数比)。
(3)计算过氧乙酸中氧元素的质量分数。(结果精确到1%)
(4)计算152克过氧乙酸中含氧元素的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】84消毒液(主要成分为次氯酸钠NaClO)可用于物体表面和环境消毒。用钛、石墨等作电极组装简易装置电解食盐水可制备次氯酸钠,能起到一定的应急作用。
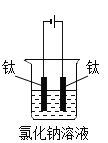
化学方程式可表示为:NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
(提出问题)改变温度、氯化钠溶液浓度、电压和电极间距是否会影响该实验呢?
(查阅资料)有效氯含量可以反映次氯酸钠含量,有效氯含量越高,次氯酸钠含量越高。
(进行实验)
实验1:20℃,钛电极间距1cm,电压10V,1L氯化钠溶液,通电1小时
实验编号 | 1-1 | 1-2 | 1-3 | 1-4 | 1-5 | 1-6 |
NaCl溶液浓度 | 1% | 2% | 3% | 4% | 5% | 6% |
有效氯含量/(g/L) | 3.5 | 3.8 | 3.9 | 4 | 3.9 | 3.7 |
实验2:1L4%氯化钠溶液,通电1小时
实验编号 | 温度/℃ | 电压/V | 钛电极间距/cm | 有效氯含量/(g/L) |
2-1 | 20 | 20 | 1 | 8.4 |
2-2 | 30 | x | 1 | 8.0 |
2-3 | 40 | 20 | 1 | 7.8 |
2-4 | 20 | 20 | 0.5 | 8.2 |
2-5 | 20 | 20 | 1.5 | 8 |
(解释与结论)
(1)由实验1可知,有效氯含量随氯化钠溶液浓度变化的规律是_____。
(2)设计实验2-1、2-4、2-5的目的是_____。
(3)实验2-2中,x=_____。
(4)能证明电压对有效氯含量有影响的实验是_____(填实验编号)。
(反思与评价)
(5)实验过程需在通风处进行并严禁烟火,原因是_____。
(6)84消毒液对皮肤和口腔黏膜具有腐蚀性和刺激性。一般市售84消毒液有效氯含量为50g/L,根据使用需要加水稀释成0.2g/L、0.5g/L、1g/L。
结合本实验,下列分析正确的是_____(填字母)。
A 使用84消毒液时建议佩戴防护口罩与手套
B 本实验中,温度越高,有效氯含量越高
C 实验2-1中,有效氯含量达到市售84消毒液标准
D 本实验制备的次氯酸钠溶液需稀释后使用
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氮气在高温、高能量条件下可与某些物质发生反应。如图是以空气和必要的原料合成氮肥(NH4NO3)的工业流程。请按要求回答下列问题:
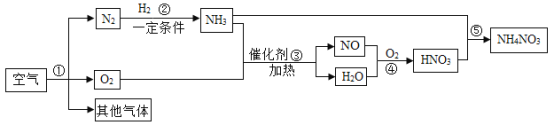
(1)步骤①是利用各物质的_____(填“熔点”或“沸点”)不同进行分离。
(2)写出步骤③中发生反应的化学方程式____,该反应中使用了催化剂,反应前后,催化剂的___没有发生改变。
(3)如图是化肥硝酸铵包装袋上的部分说明,由此推测硝酸铵具有的性质是_____(写出一点即可)。

(4)施用该肥料时,要避免与碱性物质混合使用,原因是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质间的反应如图所示,下列选项不符合图示反应关系的是
选项 | 甲 | 乙 | 丙 |
A | C | CO | CO2 |
B | Fe2O3 | Fe | FeSO4 |
C | CuSO4 | Cu(OH)2 | CuCl2 |
D | Na2CO3 | CaCO3 | CO2 |
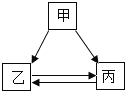
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com