
【题目】某氢氧化钙样品中含碳酸钙杂质,现称取研细的该样品12.4g放入锥形瓶中,加入32.6g的水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生。测得加入盐酸的质量与锥形瓶中的物质的质量关系如下表示:
加入盐酸的质量g | 0 | 25 | 37.5 |
锥形瓶中物质的质量g | 45 | 70 | 80.3 |
请你完成以下问题:
(1)加入盐酸的质量在0—25g时,______与盐酸发生反应;
(2)求样品中氢氧化钙的质量分数(写出计算过程,精确到0.1%)。______。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】化学兴趣小组为了探究化学实验室中的一种黑色粉末和一瓶标签破损的无色溶液(如图)可能是什么物质,大胆猜想并设计实验进行验证。

(发现问题)当把黑色粉末和无色溶液混合时即产生气泡
(查阅资料)初中化学实验室常见的黑色粉末有CuO、MnO2、Fe3O4、铁粉、炭粉等。
(提出假设)黑色粉末是_____,无色溶液是_____(只写一种假设)
(设计实验)①向盛有少许黑色粉末的试管中加入适量的无色溶液;②检验试管中产生的气体(写出操作方法)_________。
(实验现象)______________。
(实验结论)①该反应的化学方程式是____,②此气体是_____,原假设成立。

(讨论)若要制取该气体,应从如图中选择发生反应的装置是_____(填序号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类生活生产离不开金属,不仅因为其物理性能优良,还与化学性质密切相关。
(1)钛被称为“21世纪金属”,呈灰色,能在氮气中燃烧,熔点高.钛和钛合金是新型的结构材料,主要用于航天和航海工业.上述描述中属于钛化学性质的是 。
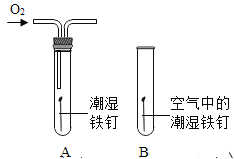
(2)某小组用图所示装置对铁生锈的条件进行探究.4min后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是 。
(3)工业生产常用10%的稀盐酸来除铁锈,写出除锈的化学反应方程式 。
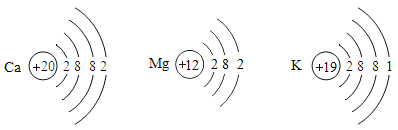
(4)在金属活动顺序表中,金属位置越靠前,越容易失去电子.Ca、Mg、K三种金属失去电子能力由强到弱的顺序是 ,如图是三种原子的结构示意图,据此推测金属失去电子能力的强弱除与最外层电子数有关外,还可能与 有关。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】填写下列表格:
化学符号 | ①_____ | 2N | ③_____ | ④_____ | 标出小苏打中碳元素的化合价 |
名称或意义 | 磷元素 | ②_____ | 3个过氧化氢分子 | 碘酒中的溶质 | ⑤_____ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下列科普材料,回答相关问题。
说起二氧化硫(SO2),你可能首先想到它是空气质量播报中提及的大气污染物。其实你真的了解SO2吗?难道它只是有害物质吗?
SO2与食品工业
SO2作为防腐剂、漂白剂和抗氧化剂广泛用于食品行业。葡萄酒酿制中适量添加SO2,可防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动。食糖加工过程中可使用SO2进行脱色。按照我国《食品添加剂使用标准(GB2760-2014)》,合理使用SO2不会对人体健康造成危害。
标准中部分食品的SO2最大残留量
食品 | 蜜饯 | 葡萄酒 | 食糖 | 水果干 | 巧克力 | 果蔬汁 |
最大残留量 | 0.35 g/kg | 0.25 g/L | 0.1 g/kg | 0.1 g/kg | 0.1 g/kg | 0.05 g/kg |
SO2与硫酸工业
硫酸是重要的化工原料,工业制硫酸的关键步骤是SO2的获取和转化。工业利用硫制硫酸的主要过程示意如下:
![]()
硫酸工业尾气中含有少量的SO2,若直接排放会污染空气,并导致硫酸型酸雨。工业上可先用氨水吸收,再用硫酸处理,将重新生成的SO2循环利用。
SO2与化石燃料
化石燃料中的煤通常含有硫元素,直接燃烧会产生SO2。为了减少煤燃烧产生的SO2污染空气,可以采取“提高燃煤质量、改进燃烧技术”的措施,例如,对燃煤进行脱硫、固硫处理;还可以采取“优化能源结构、减少燃煤使用”的措施,例如,北京大力推广的“煤改气、煤改电”工程,有效改善了空气质量。
现在,你对SO2一定有了新的认识,在今后的化学学习中你对SO2还会有更全面的认识!
依据文章内容回答下列问题。
(1)按照国家标准,食糖中的SO2最大残留量为______ g/kg;
(2)用硫制硫酸的主要过程中,涉及到的含硫物质有S、______和H2SO4;
(3)硫酸工业生产中,吸收尾气中SO2的物质是______;
(4)下列措施能减少SO2排放的是______(填序号);
A 将煤块粉碎 B 对燃煤进行脱硫
C 推广煤改气、煤改电 D 循环利用工业尾气中的SO2
(5)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下所示:![]() ,这种脱硫技术称为微生物脱硫技术。写出该技术中的第二步化学反应方程式:______。
,这种脱硫技术称为微生物脱硫技术。写出该技术中的第二步化学反应方程式:______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有A、B、C、D、E五种常见物质,转化关系如右图所示(用“→”表示一种物质能转化为另一种物质),A、B为两种盐,D俗称为烧碱,E是一种可以产生温室效应的常见气体。请利用所学知识回答下列问题:
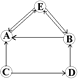
(1)请写出气体E的一种常见用途:_____;
(2)A物质的化学式为:____;
(3)写出D→B、C→A、D 反应的化学方程式:
D→B:____;C转化为A、D:____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是两种元素在元素周期表中的信息和5种粒子的结构示意图。请回答下问题:

①C、D、E、F、G中,属于同种元素的是___(填字母序号,下同),化学性质相似的是___,表示离子的是___(填离子符号);C、D、E、F、G粒子共表示___种元素。
②A和B形成的化合物的化学式是___。
③图G是碘元素的原子结构示意图,根据图可知碘元素是第___周期元素。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中MgCO3的含量,学习小组进行了实验研究.取10克菱镁矿样品,向其中逐滴加入未知质量分数的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如表:
加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(假设菱镁矿中的杂质不溶于水,不与酸发生反应.)
(1)10克菱镁矿与H2SO4溶液完全反应,生成CO2的质量为_____.
(2)该菱镁矿中MgCO3的质量分数是多少?____
(3)该实验研究中所用H2SO4溶液的溶质质量分数是多少?____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是水的电解实验中对得到气体检验的操作。

(1)操作中,盛氧气的管口向上,盛氢气的管口向下,其主要原因是 。
(2)检验氢气时,如果发生 声,表明氢气不纯,声音___________,则表示氢气比较纯,混有空气(或氧气)的氢气,点燃时易发生_________,所以点燃氢气前,一定要检验氢气的 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com