
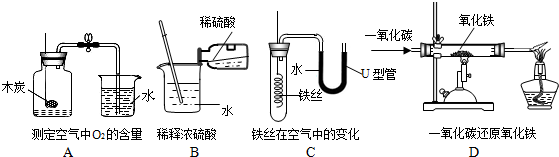
分析 (1)A、B、C、D四个实验中:A实验生成物为二氧化碳气体,不能形成气压差,故不能达到实验目的;而B、C、D三个实验可以完成,能够能达到实验目的;
(2)B实验稀释浓硫酸,玻璃棒搅拌并及时散热;
C实验铁丝生锈消耗空气中的氧气,管内外形成气压差,故U型管中液面左高右低;
D实验一氧化碳还原氧化铁,已知反应物一氧化碳和氧化铁,生成物为二氧化碳和铁,反应条件为高温;反应完,将有尾气一氧化碳,故需要处理掉.
解答 解:(1)经分析A、B、C、D四个实验,A实验生成物为二氧化碳气体,不能形成气压差,故不能达到实验目的;
(2)B中玻璃棒的作用是搅拌、散热;
一段时间后,C中的实验现象为铁丝生锈,U型管中液面左高右低;
D中硬质玻璃管内发生反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;酒精灯的作用是点燃未反应的CO,防止其污染空气.
故答案为:
(1)A;
(2)搅拌、散热;铁丝生锈,U型管中液面左高右低;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;点燃未反应的CO,防止其污染空气.
点评 了解金属生锈的条件,探究测定空气中氧气含量的方法;掌握浓硫酸的性质和稀释方法及其注意事项;掌握一氧化碳还原氧化铁的实验原理及注意事项.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 主食 | 馒头 |
| 配菜 | 红烧肉、豆腐汤、牛肉干 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浓硫酸不小心沾到皮肤上,先用干布拭去,再立刻用稀NaOH溶液冲洗 | |
| B. | 称量氢氧化钠固体时,必须在托盘天平左盘上垫一张洁净白纸 | |
| C. | 测定溶液pH值,将干燥的pH试纸浸入待测溶液片刻后取出,与标准比色卡对比 | |
| D. | 金属钠不慎燃烧不能用水扑灭,应立即用沙子覆盖 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | A-x+2 | B. | A+x+2 | C. | A-x-2 | D. | A+x-2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木炭在空气中燃烧生成二氧化碳 | |
| B. | 红磷在空气中燃烧,产生大量白烟 | |
| C. | 铁在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| D. | 硫在空气中燃烧产生微弱的淡蓝色火焰,并生成有刺激性气味的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 兴趣小组的同学为研究酸和碱反应的特点,将稀盐酸匀速、缓慢地滴入盛有氢氧化钠溶液的烧杯中,并测绘出烧杯内溶液的温度和pH的变化图象(如图所示),请回答问题:
兴趣小组的同学为研究酸和碱反应的特点,将稀盐酸匀速、缓慢地滴入盛有氢氧化钠溶液的烧杯中,并测绘出烧杯内溶液的温度和pH的变化图象(如图所示),请回答问题:| 主要成分 (均占药片质量的95%) | 主要成分的 相对分子质量 | 建议每次 服用剂量/g |
| Al(OH)3 | 78 | 0.25 |
| NaHCO3 | 84 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com