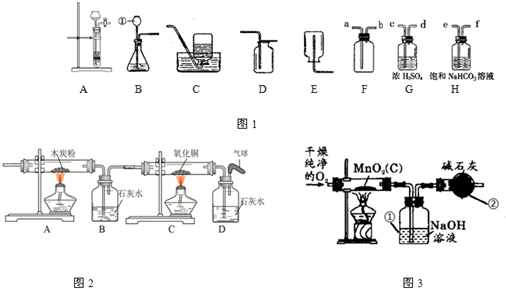
解:(1)仪器①长颈漏斗,图㈠装置可用于反应物是固体和液体反应,反应在常温下进行的反应,故可用过氧化氢在二氧化锰催化作用下分解生成氧气.
(2)用图㈡装置收集气体时,注意短导管进气,长导管出水,干燥气体时要长导管进气,短导管出气.
(3)验证二氧化碳气体可用澄清的石灰水.
(4)图㈢中碱石灰的作用是吸收空气中的二氧化碳和水蒸气,以防止空气中的氢氧化钠和碱石灰进入到空气中使试验测量结果不准.
(5)解:根据题意反应后生成二氧化碳的质量为1.1g,设生成1.1gCO2需碳的质量为x
C+O
2
CO
2
12 44
x 1.1g
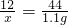
x=0.3g
则样品中二氧化锰的质量分数为:
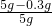
×100%=94%
故答案为:(1)长颈漏斗;2H
2O
2
2H
2O+O
2↑
(2)a;b
(3)B
(4)防止空气中的二氧化碳进入氢氧化钠溶液,导致测定结果偏高
(5)94%
分析:(1)根据仪器的图形和用途填写名称,并判断使用该装置制取氧气时的反应的化学方程式;
(2)根据实验目的和气体的密度大小选择的选择;
(3)根据实验目的,分析装置中应该盛放的药品,二氧化碳能使石灰水变浑浊;
(4)根据实验目的,分析装置中指定仪器的作用;
(5)利用化学方程式,由生成气体的质量计算参加反应的物质的质量.
点评:要想解答好这类题目,要熟记常见气体的检验与除杂方法及理论依据,还有氧气、二氧化碳等气体的相关知识,有时还需弄清图示信息,以及有关的注意事项等.


 CO2
CO2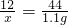
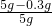 ×100%=94%
×100%=94% 2H2O+O2↑
2H2O+O2↑

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案