
【题目】氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为: 6ZnFe2O4![]() 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O![]() 3ZnFe2O4+H2↑
3ZnFe2O4+H2↑
(1)ZnFe2O4中Fe的化合价为_______________。
(2)该循环制氢中不断消耗的物质是________(填化学式),得到H2和O2的质量比为__________。
(3)氢气作为新能源的优点有________(任写一点)。该循环法制氢的不足之处是________。
Ⅱ.贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为: 2Mg2Cu+ 3H2![]() 3MgH2+MgCu2
3MgH2+MgCu2
(4)熔炼制备Mg2Cu合金时,通入氩气的目的是_________________。
(5)氢化物MgH2与水反应生成一种碱,并释放出H2。 其化学反应方程式为________。
(6)11.2g Mg2Cu完全吸氢后所得混合物与过量盐酸反应,放出H2的质量为________g。
【答案】 +3 H2O 1:8 不污染环境、热值大、原料来源丰富 能耗高 起到保护作用,防止金属被氧化 MgH2+2H2O=Mg(OH)2↓+2H2↑ 0.7g
【解析】本题考查了有关元素化合价的计算,氢能源,化学方程式的书写,根据化学方程式的计算。难度较大,仔细审题,找出的用的信息结合已有知识进行分析解答。
(1)ZnFe2O4中锌的化合价为+2价,氧元素的化合价为﹣2,设:Fe的化合价为x,根据化合物中元素化合价的代数和为零,则有(+2)+2x+(﹣2)×4=0,x=+3;
(2)根据化学方程式6ZnFe2O4![]() 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O![]() 3ZnFe2O4+H2↑可知,该循环制氢中不断消耗的物质是水,其化学式为H2O,得到H2和O2的质量比为4:32=1:8;
3ZnFe2O4+H2↑可知,该循环制氢中不断消耗的物质是水,其化学式为H2O,得到H2和O2的质量比为4:32=1:8;
(3)氢气作为新能源的优点有不污染环境、热值大、原料来源丰富,该循环法制氢时都是在高温下进行,不足之处是能耗高;
(4)高温时Mg、Cu都能与空气中氧气反应,熔炼制备Mg2Cu合金时,通入氩气可以起到保护作用,防止金属被氧化;
(5)氢化物MgH2与水反应生成一种碱,并释放出H2,根据质量守恒定律可知,生成的碱是氢氧化镁,化学反应方程式为 MgH2+2H2O=Mg(OH)2↓+2H2↑;
(6)11.2g Mg2Cu完全吸氢后所得混合物与过量盐酸反应,其中的氢化镁与水反应生成氢氧化镁和氢气,MgCu2中只有镁与盐酸反应产生氢气。
设:11.2g Mg2Cu完全吸氢后生成氢化镁的质量为x,MgCu2的质量为y。
2Mg2Cu+3H2 ![]() 3MgH2+MgCu2
3MgH2+MgCu2
224 78 152
11.2g x y
![]() x=3.9g
x=3.9g
![]() y=7.6g
y=7.6g
设:3.9g氢化镁与水反应生成氢气的质量为a
MgH2+2H2O=Mg(OH)2↓+2H2↑
26 4
3.9g a
![]() a=0.6g
a=0.6g
7.6gMgCu2含有镁的质量为:7.6g×![]() × 100%=1.2g
× 100%=1.2g
设:1.2g的镁与盐酸反应生成的氢气质量为b
Mg+2HCl═MgCl2+H2↑
24 2
1.2g b
![]() b=0.1g
b=0.1g
生成氢气的质量为:0.6g+0.1g=0.7g。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:初中化学 来源: 题型:
【题目】ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是
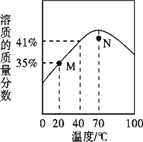
A. N点对应的ZnSO4溶液升温或降温均都可能析出晶体
B. M点对应的ZnSO4溶液是不饱和溶液
C. ZnSO4饱和溶液的溶质质量分数随温度升高而增大
D. 40℃时,ZnSO4的溶解度为41g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“—”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。
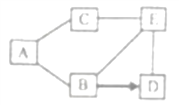
(1)A物质是________(填化学式)。
(2)C与E反应的基本类型是________。
(3)从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与B反应生成D的物质有________(填序号)。
①2类 ②3类 ③4类 ④5类
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某纯碱厂生产的某批次碳酸钠产品中可能含有氯化钠杂质。
定性检验
(1)要确定该产品中是否含有杂质氯化钠,你的方法是_________________。
定量测定:
(2)若利用沉淀法测定该产品中碳酸钠的质量分数,你确定的反应原理是(用化学方程式表示)_______________________________。
(3)假设你取样的质量为m1,根据你确定的反应原理,你需要通过实验测量沉淀(填化学式)____的质量(假设你测得的沉淀的质量为m2)。
(4)请你设计实验方案,获得数据m1、m2,把方案填在下表中。
适用的仪器名称 | 实验步骤 |
____________ | ______ |
(5)数据处理:
请用含m1、m2的式子表示所测样品中碳酸钠的质量分数,______________________。
分析讨论:
(6)要测定混合物中某成分的含量,可通过化学方法将不易测定的物质转化为易测量的物质。除沉淀法外,还可依据反应(用化学方程式表示)_______________来测定该纯碱样品中碳酸钠的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列反应中属于复分解反应的是
A. 2Mg+ O2![]() 2MgO B. Cu+2AgNO3=Cu(NO3)2+2Ag
2MgO B. Cu+2AgNO3=Cu(NO3)2+2Ag
C. CuCl2![]() Cu+Cl2↑ D. 2NaOH+H2SO4=Na2SO4+2H2O
Cu+Cl2↑ D. 2NaOH+H2SO4=Na2SO4+2H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海水晒制粗盐的主要成分为NaCl,还含有少量的MgCl2、CaCl2、MgSO4、泥沙等杂质。下面是由粗盐获取较纯净精盐的一种方法:
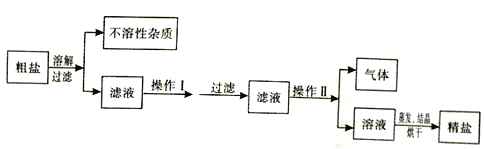
请分析上面流程图示,回答:
(1)为除去MgCl2、CaCl2、MgSO4可溶性杂质,操作I中依次加入的物质(过量)和顺序,合理的是_______;
A.NaOH、BaCl2、Na2CO3 B.Ba(NO3)2、Na2CO3、NaOH
C.Na2CO3、BaCl2、NaOH D.BaCl2、NaOH、Na2CO3
(2)操作I过量加入各物质的目的是_________;
(3)为获取较纯净精盐,操作II的具体方法是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某中学化学课外实验兴趣小组欲测定一瓶混有氯化钠的苏打中碳酸钠的质量分数。从该瓶试剂中取出20克样品,放在锥形瓶中加水至全部溶解,再加入稀盐酸,实验相关数据如下图,测得所加稀盐酸质量为m时,瓶中溶液总质量为115.6克。
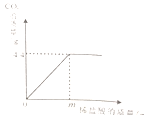
(1)该瓶苏打中碳酸钠的质量分数是______________;
(2)所加稀盐酸中溶质的质量分数是___________?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验操作容器中都有水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验 装置 |
硫在O2中燃烧 |
测定空气中O2含量 |
铁丝在O2中燃烧 |
探究燃烧条件 |
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2的体积 | 集气瓶中的水:冷却溅落融化物,防止集气瓶炸裂 | 烧杯中的水:加热铜片,隔绝空气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色 溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
实验 | A+B | A+C | A+D | B+C |
现象 | 产生气体 | 产生沉淀 | 产生沉淀 | 产生沉淀 |
①写出溶液 B、C 中溶质的化学式: B_____,C_____。
②写出溶液 A 与 D 反应的化学方程式_____。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X; 2NaHCO3Na2CO3+H2O+CO2↑等;
回答下列问题:
①X 的化学式为_____。
②将碳酸钠和碳酸氢钠的混合物 l0g 充分加热至质量不再改变,冷却,称量剩余固体 质量为 6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为_____(写最简比)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com