

分析 (1)根据氢气还原氧化铜的实验顺序和一氧化碳的毒性来分析;
(2)根据题干信息以及化学方程式的书写方法来分析解答.
(3)根据酒精喷灯和普通酒精灯的差异分析.
解答 解:(1)实验结束后,某同学发现试管里红色的物质又变成黑色,原因是灼热的铜和空气反应生成黑色氧化铜,即没有继续通入H2直至试管冷却;
因为一氧化碳有毒,不能直接排到大气中,可以用点燃的方法除去一氧化碳,所以应该先点燃后面的酒精灯,故填:先熄灭酒精灯,继续通入H2直至试管冷却;先点尾灯,后通CO;
(2)因为氧化亚铁能溶于酸,而四氧化三铁不能溶于酸,故黑色固体为四氧化三铁,故填:C+6Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$4Fe3O4+CO2↑.
(3)酒精喷灯比普通酒精灯可以提供更高的温度,所以应该是由于温度不够高导致乙实验的冶炼效果不理想.故填:加热的温度不够高.
点评 本题考查了还原氧化铁的注意事项以及化学方程式的书写,难度不大.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 能使紫色石蕊溶液变红 | B. | 能与氢氧化钠反应生成水 | ||
| C. | 能与CuO反应生成水 | D. | 能与BaCl2溶液反应生成BaSO4沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 A、B、C、D、E、F都是初中化学常见的物质,它们之间的关系如图所示.(图中“一”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系.)其中:B是常用于光合用的气体,D是一种微溶于水的物质,B与E不含相同元素,D与A含两种相同元素.
A、B、C、D、E、F都是初中化学常见的物质,它们之间的关系如图所示.(图中“一”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系.)其中:B是常用于光合用的气体,D是一种微溶于水的物质,B与E不含相同元素,D与A含两种相同元素.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
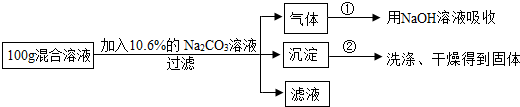
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 不能用铁器盛放硫酸铜溶液的原因:Fe+CuSO4═FeSO4+Cu | |
| B. | 工业上用赤铁矿炼铁:Fe2O3+2CO$\frac{\underline{\;高温\;}}{\;}$2Fe+2CO2 | |
| C. | 医疗上用碱性物质治疗胃酸过多:Mg(OH)2+H2SO4═MgSO4+2H2O | |
| D. | 制取少量硫酸铝:2AlCl3+3H2SO4=Al2(SO4)3+6HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com