
【题目】请按照要求写出下列化学方程式,并回答问题。
(1)木炭的不完全燃烧______,该反应属于____(选填“放热”或“吸热”)反应。
(2)碳酸氢铵受热分解______,产生刺激性气味的气体可以用______试纸检验。
(3)铜丝放入硝酸银溶液中______,该反应的基本反应类型是_____。
(4)铝具有“自我保护”的化学原理是_____。
(5)利用熟石灰与硫酸铵混合研磨检验铵态氮肥______。
【答案】2C+O2![]() 2CO 放热 NH4HCO3
2CO 放热 NH4HCO3![]() NH3↑+CO2↑+H2O 湿润的红色石蕊 Cu+2AgNO3=2Ag+Cu(NO3)2 置换反应 4Al+3O2═2Al2O3 (NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O
NH3↑+CO2↑+H2O 湿润的红色石蕊 Cu+2AgNO3=2Ag+Cu(NO3)2 置换反应 4Al+3O2═2Al2O3 (NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O
【解析】
(1)碳在少量氧气中燃烧生成一氧化碳,反应的化学方程式为2C+O2![]() 2CO;该反应属于放热反应;
2CO;该反应属于放热反应;
(2)碳酸氢铵受热分解生成氨气,二氧化碳和水,该反应的化学方程式为:NH4HCO3![]() NH3↑+CO2↑+H2O;氨气是具有刺激性气味的气体,显碱性,故可以用湿润的红色石蕊试纸检验;
NH3↑+CO2↑+H2O;氨气是具有刺激性气味的气体,显碱性,故可以用湿润的红色石蕊试纸检验;
(3)铜丝放入硝酸银的溶液中,发生的反应为置换反应,故Cu+2AgNO3=2Ag+Cu(NO3)2;反应符合A(单质)+BC=B(单质)+AC的特点,故属于置换反应;
(4)铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式为:4Al+3O2═2Al2O3.
(5)硫酸铵与熟石灰混合,生成硫酸钙、氨气和水,反应的化学方程式为:(NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O;
故答案为:(1)2C+O2![]() 2CO;放热;(2)NH4HCO3
2CO;放热;(2)NH4HCO3![]() NH3↑+CO2↑+H2O;湿润的红色石蕊;(3)Cu+2AgNO3=2Ag+Cu(NO3)2;置换反应;
NH3↑+CO2↑+H2O;湿润的红色石蕊;(3)Cu+2AgNO3=2Ag+Cu(NO3)2;置换反应;
(4)4Al+3O2═2Al2O3;(5)(NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O。


 口算题天天练系列答案
口算题天天练系列答案科目:初中化学 来源: 题型:
【题目】用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )
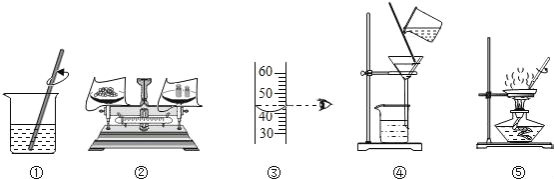
A.甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B.甲实验各步操作中,玻璃棒的作用都是相同的
C.乙实验若按照②③①的步骤进行操作,则配制的溶液浓度偏大
D.乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明、小芳二位同学为探究盐酸的化学性质,做了如下实验:
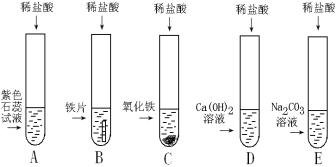
(1)试管A中的现象是 ,反应后试管B中一定有的阳离子是 (写离子符号)。
(2)试管C中反应的化学方程式为 。小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。过滤,得到白色沉淀和无色滤液。
小芳同学欲探究无色滤液中的溶质成分:
小芳同学分析得出无色滤液中一定不含HCl,理由是 。
【提出问题】无色滤液的溶质是什么?
【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl 、CaCl2和Na2CO3;④NaCl和Na2CO3。
小明认为猜想 一定不正确。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想 成立 |
②取少量滤液于试管中,滴加少量 | 有气泡产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,已知物质X是一种生活中常用的调味品,其余四种物质在一定条件下都可以转化成X,其中反应②和反应③的生成物完全一样,图中五种物质均含同种金属元素。试推断:
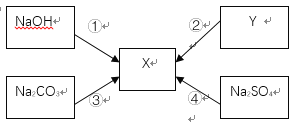
(1)写出Y的化学式: _____________。
(2)若①为中和反应,写出一个符合的反应方程式 ______________ ,为了证明两种反应物恰好完全反应,最好在装有氢氧化钠溶液的烧杯中先加入__________,然后再逐滴加入另一种溶液至溶液颜色恰好改变。
(3)写出一个符合反应④发生的化学方程式:_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。

【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与镁条接触的物质,利用右图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸 再通入约4mL CO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液 再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水 再通入约4mL CO2 | 镁条第3天开始变黑 至第20天全部变黑 |
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是____________(用化学方程式表示)。
(2)实验1的目的是____________。
(3)实验3中,试管内的气体主要含有CO2、__________。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是___________(填编号)。
(5)由上述实验可推知,镁条变黑的条件是___________。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是__________。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是__________。
【定量分析】小陆同学取了实验室存放较久的1克镁条和20克稀硫酸(足量)放入一支质量为30克的试管中,看到产生较多气泡,等没有气泡后精确称量,得到试管和内容物总质量为50.92克,小陆同学认为此反应产生的全部为氢气。试帮小陆同学计算这1 克镁条中还含有多少镁?
__________
同学们经过讨论一致认为在操作和称量准确的情况下,实际含有的镁要小于计算结果。请你分析可以有原因_____________________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据统计:2016年,中国粗钢产量为8.084亿吨,同比增长1.2%,占世界总产量的比重达49.6%,生产了全球近一半的钢铁。请结合以下信息和所学知识,回答问题。

(1)工业炼铁使用图Ⅰ设备,名称是____,炼铁时将图Ⅱ中固体原料按一定配比与图Ⅲ中的富氧热空气共同投入炼铁设备中,原料的投放口为______(填“方案一”或“方案二”)。
方案一:固体原料从A口投入,热空气从B口进入;
方案二:固体原料从B口投入,热空气从A口进入;
选择此方案的优点是______。
(2)根据炼铁的原理:①先将焦炭燃烧产生CO2;②再进一步产生还原剂CO;③利用CO将赤铁矿中的铁还原出来。请写出③的化学反应方程式:______;
(3)若某炼铁厂用赤铁矿生产1吨生铁(含杂质4%),则理论上参加反应的CO为多少吨______?(请写出具体计算过程,注意格式)
(4)资料显示,若生产1吨生铁(含杂质4%),需要2.0吨赤铁矿、0.5吨焦炭以及0.3吨熔剂。某同学通过理论计算得出本次生产只需焦炭0.3吨,分析实际用量远高于理论值的原因可能有______(填字母)。
A 部分焦炭与铁相互熔合,成为生铁中的部分碳元素
B 焦炭在高温下分解
C 焦炭转变成一氧化碳后,并未全部参加反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。

请根据以上信息计算:
(1)样品中碳酸钙的质量分数?
(2)C烧杯中溶液的溶质质量分数?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)某燃料X在7.2g氧气中燃烧,得到9.2g混合气体(可能含有一氧化碳、二氧化碳、水蒸气)。化学兴趣小组的同学利用下图所示装置验证混合气体的成分。
资料:①浓硫酸具有吸水性。②浓氢氧化钠溶液能吸收二氧化碳。
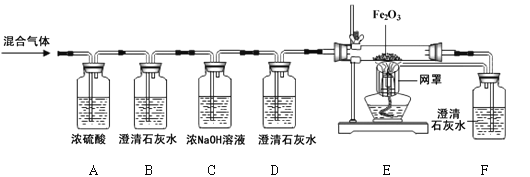
(1)通过混合气体后,A装置增重4.5g,说明混合气体中含有________________________。
(2)B装置中澄清石灰水变浑浊,发生反应的化学方程式为 。D装置的作用是 。
(3)当观察到 ,证明混合气体中有CO。
(4)实验结束后,同学们称量B、C装置共增重3.3g,根据以上数据可确定燃料X中所含元素及元素质量比为_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定某地大理石样品中碳酸钙的含量进行了相关实验,取样品25g将200g稀盐酸分五次加入大理石样品中(杂质不溶于水也不参与反应),充分反应后测得剩余固体的总质量如下表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 40 | 40 | 40 | 40 | 40 |
剩余固体的总质量/g | 20 | 15 | 10 | 5 | 5 |
试求:
(1)20g大理石样品中杂质的质量为_____g
(2)所用稀盐酸溶质的质量分数_____?
(3)反应完全后所得溶液中溶质的质量分数_____?(写出计算过程,计算结果精确至0.1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com