
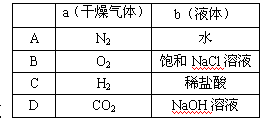
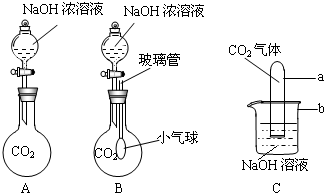
4.在下图装置中,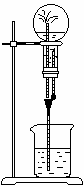 烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹p,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹p,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2008年北京市通州区初三一模化学试卷 题型:059
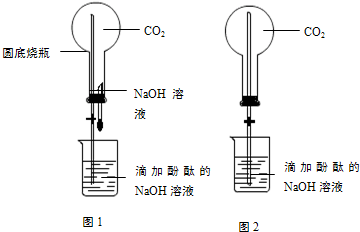
探究二氧化碳能否和氢氧化钠反应时,小明用自己设计的三个装置(见下图)进行实验,请你参与并解答问题:
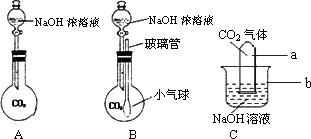
(1)写出标有字母的仪器名称:
a________,b________.
(2)A实验因选用的仪器不当导致未能观察到明显现象,无法判断是否发生反应.请你寻找一种物品替代该装置中的烧瓶,来使实验获得成功,你选的物品是________.
(3)在B的实验中可观察到烧瓶内的小气球逐渐的变大了;在C的实验中你观察到的现象为________.有关的化学方程式为________.
(4)小明还想探究二氧化碳和氢氧化钠反应后的生成物中是否有碳酸盐,你的实验方案设计是:________.
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省南京市江宁区中考一模化学试卷(解析版) 题型:探究题
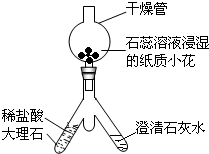
化学中质量守恒定律是一个非常重要的定量定律。
(1)如下图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为 m2,则(填“=” “>”“<”)m1 m2 ,其原因为 。

(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料。燃烧反应前后分子种类变化的微观示意图如下所示。

①1个B分子中含有 个原子。
②四种物质中属于化合物的是 (填图中字母)。
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量 和都是l0g。有关实验数据见下表:
序号 反应前A的质量 反应前B的质量 反应后A3B2的质量
① 8g 2g 6g
② 4g 6g 6g
③ xg yg 9g
X∶Y的比值可能为 或 。
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
《提出问题》样品中碳酸钠的质量分数是多少?
《知识准备》食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发。
《设计方案》(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
《进行实验》甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀20.00g。
乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳。
《解决问题》请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(写出计算过程。计算结果精确到0.1% )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com