(2007?常德)如图是实验室常用的实验仪器与装置.依据题目要求回答下列问题:
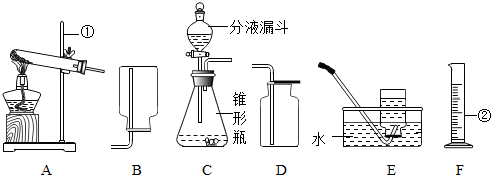
(1)写出标号仪器的名称 ①
铁架台
铁架台
; ②
量筒
量筒
.
(2)制取氧气有多种方法,如分解过氧化氢溶液、加热高锰酸钾、
加热氯酸钾(或电解水)
加热氯酸钾(或电解水)
等.
(3)采用分解过氧化氢溶液制氧气有许多优点,如:
①②
①②
(填序号).
①产物无污染 ②不需加热 ③需加热 ④生成物只有氧气
(4)为确定某集气瓶最多可收集氧气的体积,请设计一个简便的测量方法(仪器用品等任选):
先向集气瓶中盛满水,再用量筒量出集气瓶中水的体积即可(其它合理答案也可)
先向集气瓶中盛满水,再用量筒量出集气瓶中水的体积即可(其它合理答案也可)
(5)甲同学用分解过氧化氢溶液的方法制取并收集氧气应分别选择
C、D(或C、E)
C、D(或C、E)
装置(填字母);
除过氧化氢溶液外,通常还需要的一种药品是
MnO2
MnO2
(填化学式),其作用是
加快化学反应速率(或催化作用)
加快化学反应速率(或催化作用)
;加入药品前应注意检查装置的
气密
气密
性.
(6)乙同学选择装置A以高锰酸钾为原料制取氧气,他在该装置试管内的导管口处添加了一团棉花,其目的是:
防止加热时高锰酸钾粉末进入导管
防止加热时高锰酸钾粉末进入导管
.
(7)丙同学对乙同学的制氧装置产生了质疑.他认为加热高锰酸钾时,在试管较小的空间内氧气浓度高、温度也较高,而棉花是易燃物质,实验时可能会发生危险,他建议采用不易燃烧的丝状物质代替棉花更安全.丙同学的观点是否正确,你认为最科学的判断依据是
③
③
(填序号).
①依据教科书的观点 ②依据老师的观点 ③依据实验事实.




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 ”、“
”、“ ”表示不同元素的原子,“
”表示不同元素的原子,“ ”、“
”、“ ”、“
”、“ ”分别表示A、B、C三种不同的分子,则该化学反应方程式中A、B、C前的化学计量数之比是( )
”分别表示A、B、C三种不同的分子,则该化学反应方程式中A、B、C前的化学计量数之比是( )

 (2007?常德)据有关部门统计:每年全世界因生锈损失的钢铁约占钢铁年产量的四分之一.为此,某同学对铁钉锈蚀的条件产生了研究兴趣,并设计了如图所示的实验.据此请回答以下问题:
(2007?常德)据有关部门统计:每年全世界因生锈损失的钢铁约占钢铁年产量的四分之一.为此,某同学对铁钉锈蚀的条件产生了研究兴趣,并设计了如图所示的实验.据此请回答以下问题: (2007?常德)某同学为了研究影响金属与酸反应速率的因素,进行了一系列的探究实验.实验结果如图所示,图中每条斜线表示:该金属和对应酸的反应时间与生成氢气质量的关系.由图中的信息我们可以分析出影响金属与酸反应速率的因素有:
(2007?常德)某同学为了研究影响金属与酸反应速率的因素,进行了一系列的探究实验.实验结果如图所示,图中每条斜线表示:该金属和对应酸的反应时间与生成氢气质量的关系.由图中的信息我们可以分析出影响金属与酸反应速率的因素有: