
【题目】下表为氯化钠和硝酸钾的溶解度:
温度 溶解度/g/100g水 物质 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(1)20℃时 KNO3 的溶解度_____(选填“大于”“小 于”)NaCl 的溶解度。随着温度升高,NaCl 的溶解度_____(选填“变大”“变小”或“不变”)。
(2)20℃时,完全溶解 18 g NaCl 恰好得到饱和溶液,所需水的质量是_____g,该溶液质量分数为_____。
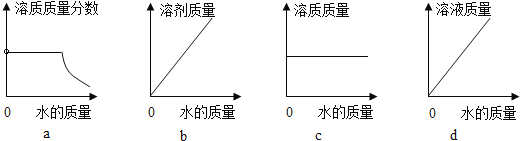
(3)20℃时,向 10 g KNO3 固体不断加水,有关图像正确的是_____(选填编号)。
(4)NaCl中含有少量KNO3提纯NaCl采用的方法是_____(选填“蒸发结晶”或“降温结晶”)。
(5)在最新爆发的 “新型肺炎”疫情的医疗上常用溶质质量分数为0.9%的生理盐水为载体给患者输液。某化学兴趣小组欲配制500g溶质质量分数为0.9%的氯化钠溶液。现有如下操作:①装瓶、贴签;②溶解氯化钠;③秤取氯化钠固体;④量取蒸馏水,正确的操作顺序是_____;在量取水时,俯视刻度线会导致所配制溶液的溶质质量分数_____(填“偏大”、“偏小”或“无影响”)。
【答案】小于 变大 50 26.5% ab 蒸发结晶 ③④②① 偏大
【解析】
(1)由表可知,20℃时KNO3的溶解度为31.6g,氯化钠的溶解度为36g,故20℃时KNO3的溶解度小于NaCl的溶解度;由表可知,随着温度升高,NaCl的溶解度变大;
(2)由表可知,20℃时,氯化钠的溶解度为36g,即该温度下,氯化钠在100g水中达到饱和时,所溶解的质量为36g,故该温度下,完全溶解18gNaCl恰好得到饱和溶液,所需水的质量是50g;该溶液的质量分数是:![]() ;
;
(3)a、20℃时,向 10 g KNO3 固体不断加水,一开始,硝酸钾未完全溶解,溶液为饱和溶液,温度不变,饱和溶液的溶质质量分数不变,待硝酸钾完全溶解后,随着水的加入,溶质质量不变,溶液质量增大,溶质质量分数逐渐减小,符合题意;
b、20℃时,向 10 g KNO3 固体不断加水,随着水的加入,溶液中溶剂的质量不断增大,符合题意;
c、20℃时,向 10 g KNO3 固体不断加水,一开始,溶液中溶质的质量随着硝酸钾的溶解不断增大,待硝酸钾完全溶解后,溶质质量不再变化,不符合题意;
d、当硝酸钾未完全溶解时,随着水的加入,溶液质量逐渐增大,待硝酸钾完全溶解后,随着水的加入,溶液质量逐渐增大,但是增加幅度变小,不符合题意。故选ab;
(4)由表可知,氯化钠、硝酸钾的溶解度都随温度的升高逐渐增加,氯化钠的溶解度受温度影响较小,硝酸钾的溶解度受温度影响较大,故NaCl中含有少量KNO3提纯NaCl采用的方法是:蒸发结晶;
(5)配制一定溶质质量分数的溶液的实验步骤为:计算、称量、量取、溶解、装瓶,故正确的操作顺序是:③④②①;
俯视读数,读取数值大于实际数值,会使量取水的质量偏小,从而导致溶液质量偏小,溶质质量不变,溶液质量偏小,故溶质质量分数偏大。


科目:初中化学 来源: 题型:
【题目】某同学利用下列装置制取氧气并验证氧气的性质。

(1)请写出编号为①的仪器名称______。
(2)实验室用过氧化氢溶液制取氧气可选用的发生装置是______(填序号),发生反应的化学方程式为______。
(3)用装置D收集氧气的依据是______,用这种方法收集氧气,验满的方法是______。
(4)在实验室用B、F装置制取氧气,选用的试剂是______,发生反应的化学方程为______,试管口放棉花的作用为______,实验前必须进行的操作是______,实验结束时的操作是______。
(5)用坩埚钳夹取一小块木炭加热到发红后,插入到收集的氧气中(具体操作是______),观察到的现象是______。
(6)点燃系在光亮细铁丝下的火柴,待______时,插入充满氧气的集气瓶中,观察到的现象是______,集气瓶内预先放入少量水的目的是______,该反应的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国是全球最大的纯碱生产大国,纯碱产量多年来一直稳居世界首位。“十三五”期间纯碱行业以节能减排为着力点,推进产业转型升级。氨碱法制碱用于实验制备纯碱的部分简单流程如下图所示。
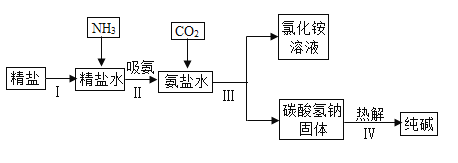
(1)氨气极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水)。请分析氨盐水比食盐水更容易吸收二氧化碳的原因是_______;
(2)氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,首先析出物质的是___________,其原因是___________;
(3)请分别写出步骤Ⅲ、步骤Ⅳ反应的化学方程式为______、_____。其中副产品氯化铵是一种____(选填“氮”、“磷”、“钾”或“复合”)肥。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】仔细阅读下面的探究实验信息,回答相关问题。
I.[实验目的]探究溶解过程中,溶液温度的变化情况。
II.[查阅资料]
(1)物质溶解于水的过程包括吸收热量(Q吸)的扩散过程和放出热量(Q放)的水合过程。
(2)实验条件下,水的凝固点为0℃、沸点为100℃。
III.[提出猜想]物质溶解过程中,溶液的温度可能升高或降低或不变。
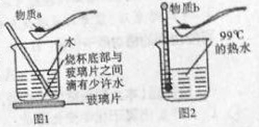
IV.[实验探究]某探究小组的同学设计了如下图所示的两种实验方案。在图2所示方案中,每次加入物质b之前,均使用温度计控制热水温度,使之保持在99℃。
V.[实验结论]
(1)图1所示实验中,若加入物质a后,发现玻璃片与烧杯底部之间的水结冰,说明溶液的温度_____(填“升高”或“降低”或“不变”,下同)。
(2)图2所示实验中,若加入物质b后,热水会突然沸腾,说明溶液的温度__________。
VI.[拓展实验]按照图3所示进行实验。若物质c为NaOH,则U型管内的左边液面将_______(填“升高”或“低于”或“等于”)右边液面;若U型管内的液面位置变化与之相反,则物质c为______(填序号)。
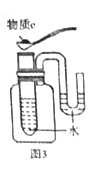
①CaO ②NH4NO3 ③浓H2SO4
VII.[反思交流]
(1)该小组的同学进一步就物质溶解过程中溶液温度变化的原因展开了讨论,分析得出:若Q吸_____Q放(填“>”或“<”或“=”,下同),则溶液温度升高;若Q吸与Q放的相对大小与之相反,则溶液温度降低;若Q吸_____Q放,则溶液温度不变。
(2)在图2所示方案中,小张同学对实验现象很感兴趣,他继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,再继续加入相同质量的物质b,就看不到沸腾现象。请解释不再产生沸腾现象的原因________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C三种物质的溶解度曲线如图所示。下列分析正确的是
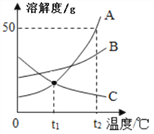
A. 三种物质的溶解度:A>B>C
B. t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:2
C. 将t2℃时,A、B两种物质的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数的大小关系是B>A
D. 将C的饱和溶液变为不饱和溶液,可采用升温的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语填空:
(1)2个氧原子______;
(2)铁离子______;
(3)保持水的化学性质的最小粒子_________;
(4)高锰酸钾中锰元素的化合价______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国国家发改委等七部委联合发布公告称,2019年1月1日起,全国全面供应符合第六阶段强制性国家标准VIA车用汽、柴油,即油品中硫含量要求不大于0.001%(10ppm)。
(1)目前,多数燃油汽车使用的燃料是汽油或柴油。我国大中城市所有机动车都要进行尾气检测,其中包括PM2.5的检测。汽柴油燃烧产生的颗粒物主要是____,这是汽柴油________(填“完全”或“不完全”)燃烧产生的。
(2)我国“国六”汽柴油标准属世界最高质量标准,油品硫含量指标限值为每千克10毫克,硫是危害汽车催化器的最大杀手,升级成品油质量降低其含硫量,对治理空气污染的好处在于(至少一点)___________。
(3)我国“国六”标准的氮氧化物降低了42%。使用催化净化装置,采用铂钯合金作催化剂,将汽车尾气中CO和NO发生反应,生成两种参与大气循环的无毒气体,该反应的化学方程式为___________。
(4)2019年1月1日起,我国全面供应国六标准汽柴油,请从资源、环境两方面说明,提出治理汽车污染的合理化建议:___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属钨(W)可做白炽灯泡的灯丝。用黑钨矿(主要含 FeWO4)制得金属钨的工艺流程如下图所示:

(1)将黑钨矿石碾成粉末,目的是_________。
(2)酸浸槽中,发生了复分解反应,化学方程式为_________。
(3)还原炉中,反应前后,元素化合价降低的元素是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国推广使用乙醇汽油,到2020年在全国范围内基本实现车用乙醇汽油全覆盖。根据乙醇的化学式C2H5OH,通过计算回答:
(1)乙醇的相对分子质量为______。每个分子中共有____个原子。
(2)乙醇中碳、氢元素的原子个数比为______(填最简整数比)。
(3)乙醇中碳、氢和氧四种元素的质量比为______。
(4)乙醇中氢元素的质量分数为_______(计算结果精确到0.01%)。
(5)92g乙醇中含有氧元素的质量为_____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com