
【题目】如图是A、B两种固体物质的溶解度曲线:
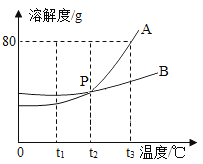
(1)p点表示的意义_________。
(2)t1℃时,两种物质的溶解度由大到小的顺序为________。
(3)t3℃时,将45g的A物质加入到盛有50g水中的烧杯中,充分搅拌,得到溶液的质量为_______g。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】25℃时,向盛有等质量的甲、乙、丙三种固体的试管中,分别加入等量的水,充分溶解后,甲、乙还有剩余,丙全部溶解。然后将三支试管加入盛有80℃水的烧杯中,甲仍有固体未溶解,乙全部溶解,丙有固体析出,如图1所示。请回答:
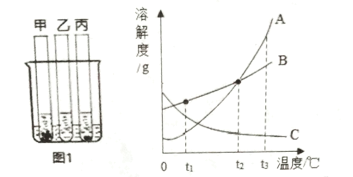
(1)图1中烧杯里的三个试管内,____________(选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液。
(2)图2中能表示丙物质的溶解度曲线的是___________ ( 选填“A”、“B”或“C”)。
(3) t3℃时, 甲的饱和溶液中含有少量乙物质,提纯甲物质的方法是________________________。
(4) t3℃时,等质量的甲、乙两种物质的饱和溶液中,降温至t2℃,对所得溶液分析,下列说法正确的是___________(填选项)。
①溶质质量:甲<乙
②溶剂质量:甲>乙
③溶质质量分数:甲=乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】造纸是我国古代四大发明之一,它有效地推动了人类文明的发展。
(1)回收农田产生的秸秆作为造纸原料,可以减少焚烧秸秆带来的______污染。秸秆的主要成分是纤维素[(C6H1005)n],纤维素中C、H、O三种元素的质量比为______(用最简整数比表示)。
(2)造纸会产生大量含NaOH的碱性废水,需经处理呈中性后排放。
①检测废水呈碱性的简单方法是_____。
②若某造纸厂废水中NaOH的质量分数为l.6%,现有废硫酸9.8 t(H2SO4的质量分数为20%),可以处理的废水质量是多少?(计算过程写在答题卡上)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】果果准备从减轻飞船发射质量和消除呼吸过程产生的二氧化碳等两个方面进行考虑,我国“神州”系列飞船需要安装特种的供氧设备,新型的航天飞行器座舱内空气更新过程如下图所示,请你仔细观察分析此图,试回答:

(1)装置I的作用是____________。空气净化器中使用具有强吸附性能的活性炭,则净化空气时主要发生了______变化(选填“物理”或“化学”)。
(2)装置Ⅱ是CO2和H2的反应装置,请根据该反应的流程,写出该反应的化学方程式(不要求注明反应条件)为____________________;
(3)装置Ⅲ发生的反应是通过太阳能电池产生的直流电来电解水,则该反应的化学方程式为_____________,其反应的基本类型为______________。
(4)从装置I、Ⅱ和Ⅲ可看出,航天员呼吸所需的氧气来源是CO2和H2O,若航天员每12小时呼出的气体中含528g二氧化碳和72g水蒸气,则通过Ⅰ、Ⅱ和Ⅲ装置完全转化后可得到氧气的质量为__g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】果果了解到农作物秸秆是一种宝贵的生物质能,综合开发利用我国产量巨大的农作物秸秆将大有作为,以秸秆为原料的生物可用于发展秸秆发电和颗粒燃料能,还可用作养殖饲料、沼气化利用、造纸、生产装饰板和有机肥等方面。则回答:
(1)果果在秋收时节观察到本地还有零星的秸杆焚烧现象,这样会造成巨大的资源浪费。尤其是焚烧秸秆可能导致的后果有(至少两点)__________________。
(2)农作物秸秆蕴含丰富的____(“可再生”或“不可再生”)生物质资源,在生产沼气的过程则主要发生了______(填“物理”或“化学”)变化。生态农业大量使用沼气作为新能源,沼气的主要成分是甲烷,可用于煮饭、照明、取暖。请写出甲烷(CH4)完全燃烧的化学方程式为______________。
(3)清洗沼气池和定期检查时,要注意避免明火,否则容易发生_______事故。请分析其原因为_______________。
(4)绿色农庄推广使用一种新型一次性可降解餐盒,以棉花秸秆为原料研制而成,废弃后在自然条件下两个月就可自然降解。请分析其中的优点之一是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )

A. t1℃时,a、c两种物质饱和溶液的溶质质量分数为20%
B. 将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
C. 将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c
D. 将150g a物质的饱和溶液从t3℃降温至t1℃,可析出30g a物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组要配制100g质量分数为20%的碳酸钠溶液,下图是他配制碳酸钠溶液的实验操作示意图。请回答下列问题:
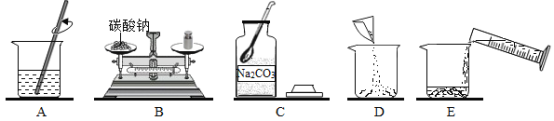
(1)计算配制100g溶质质量分数为20%的碳酸钠溶液所需:碳酸钠_____g;水_____mL,量取所需要的水应选择_____(选填“10 mL”、“50 mL”或“100 mL”)量筒。
(2)用上述图示的序号表示配制溶液的操作顺序:_____。
(3)在配制碳酸钠溶液的过程中应该用到的玻璃仪器分别有_____。
(4)如果称取的碳酸钠中含有少量水分,最后配制的碳酸钠溶液的浓度将_____(填“偏高”、“偏低”、或“无影响”)。
(5)用托盘天平正确称量所需的碳酸钠时,发现托盘天平的指针偏向左盘,应_____(填序号)
A 增加适量的碳酸钠固体 B 减少适量的碳酸钠固体 C 调节平衡螺母 D 增加砝码
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐溶解性表是学习化学的重要工具,下表列出了部分酸、碱、盐在20℃时的溶解性,我能利用此表完成以下任务:

(1)从表中查出Ca(OH)2的溶解性为_____,解释保存浓盐酸需要密封的理由_____。
(2)按要求写化学式:一种酸 _____,一种不溶于水的盐 _____。
(3)作出判断:氯化钠溶液与硝酸钙溶液能否发生反应及其理由是_____。
(4)按照要求写化学方程式:①铝与表中的可溶性盐发生的反应_____。
②溶解性表中物质发生的有沉淀生成的复分解反应_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用。结合图中信息,下列叙述正确的是( )
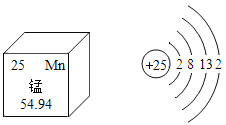
A.锰原子核内有25个质子,一个锰原子的质量是54.94g
B.锰原子核外有4个电子层,其化学性质由最内层电子数决定
C.MnO2属于氧化物,能做所有化学反应的催化剂
D.KMnO4为紫黑色固体,易溶于水形成紫红色溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com