请从以下I、II两道题中任选一道完成:
I.现有氯化钠和碳酸钠的混合物20克,为了除掉其中的碳酸钠,得到纯净的氯化钠溶液,小明同学将该混合物放入一定量的水中配制成60克溶液,再向其中加入50克氯化钙溶液,恰好完全反应,生成了白色沉淀,过滤后得到100克溶液.
(1)求所得氯化钠溶液中溶质的质量分数:(要求写出计算过程).
(2)小明同学的方案中氯化钙溶液很容易过量而引入新的杂质,你提出的既能除去碳酸钠杂质,又能有效地防止新杂质引入的新方案是:
.
II.已知某纯碱试样中含有氯化钠,为测定试样中纯碱的质量分数,可用下图装置进行实验.(已知装置A中试剂X为氢氧化钠溶液,碱石灰为氢氧化钠与氧化钙固体的混合物)
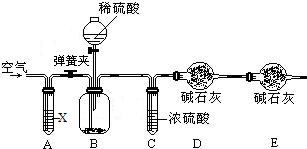
主要步骤如下:①按图组装仪器,并检查装置气密性;②准确称得6.0g纯碱试样放入装置B的广口瓶中:
③从A中导管缓缓通入空气一段时间后,关闭弹簧夹;④称得盛有碱石灰的干燥管D的质量为183.4g;
⑤从分液漏斗中滴入98g稀硫酸时气泡不再产生:⑥打开弹簧夹,再从A中导管缓慢通入空气一段时间;
⑦再次称量干燥管D的总质量为185.6g.
(1)试样中纯碱的质量分数为多少?(要求写出计算过程).
(2)为了减小误差,步骤③和⑥中都通入了一段时间的空气,请就其中一处谈谈若省略该步骤后对测量结果造成的影响
.




 通城学典默写能手系列答案
通城学典默写能手系列答案